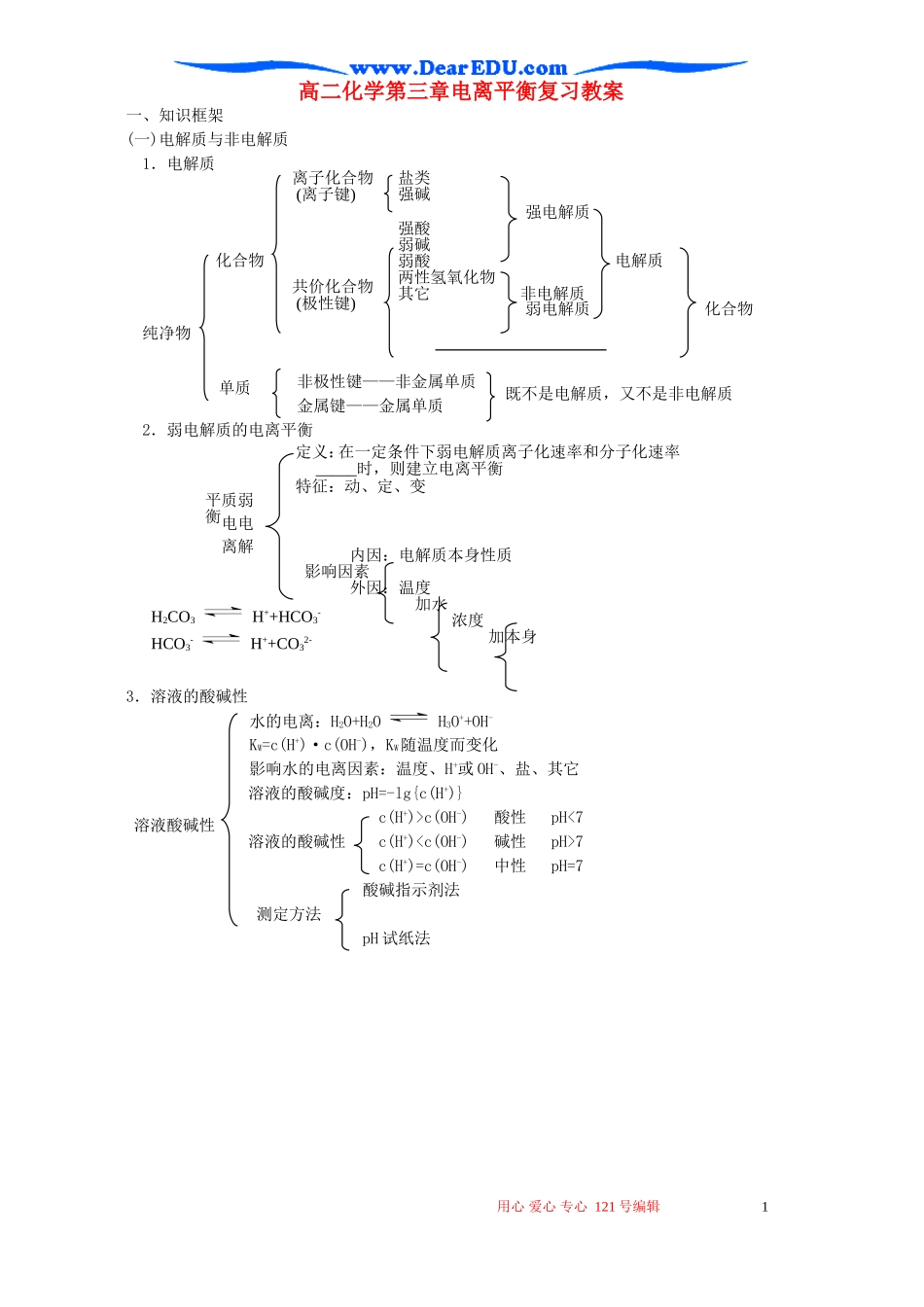
盐类强碱强酸弱碱弱酸两性氢氧化物其它非电解质高二化学第三章电离平衡复习教案一、知识框架(一)电解质与非电解质1.电解质强电解质化合物电解质弱电解质化合物纯净物非极性键——非金属单质金属键——金属单质2.弱电解质的电离平衡3.溶液的酸碱性水的电离:H2O+H2OH3O++OH-KW=c(H+)·c(OH-),KW随温度而变化影响水的电离因素:温度、H+或OH-、盐、其它溶液的酸碱度:pH=-lg{c(H+)}c(H+)>c(OH-)酸性pH<7溶液的酸碱性c(H+)7c(H+)=c(OH-)中性pH=7酸碱指示剂法测定方法pH试纸法用心爱心专心121号编辑1溶液酸碱性离子化合物(离子键)共价化合物(极性键)既不是电解质,又不是非电解质单质定义:在一定条件下弱电解质离子化速率和分子化速率_____时,则建立电离平衡特征:动、定、变内因:电解质本身性质影响因素外因:温度加水浓度加本身弱电解质电离平衡H2CO3H++HCO3-HCO3-H++CO32-关键单水解仪器试剂操作中和滴定4.有关计算(两强酸溶液混合)(两强碱溶液混合)(酸碱溶液混合且其中一者过量)稀释(二)盐类水解实质:盐电离出来的弱酸根或弱碱离子与水电离出的______或______结合生成_____电离的分子或离子,破坏水的______平衡①有弱才水解,谁强显谁性;越弱越水解,越强难水解②盐的浓度越小,水解程度越大。③温度越高,水解程度越大①判断溶液的酸碱性②判断电解质的相对强弱(酸或碱的强弱)③比较溶液中微粒浓度大小(电荷守恒、物料守恒、质子守恒)④解释某些化学现象及在生产生活中的应用强碱与多元弱酸组成的正盐——分步水解,第一步为主强酸与多元弱碱组成的正盐——简化为一步水解多元弱酸酸式盐——既有酸式离子水解,又酸式离子电离,溶液的酸碱性由水解和电离程度的相对大小决定双水解:一般能进行到底,离子方程式用==、↑或↓等(三)中和滴定定义:用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法原理:在中和反应中使用一种已知浓度的酸(或碱)溶液与未知浓度的碱(或酸)溶液完全中和,测出二者所用的体积,根据化学方程式中酸碱物质的量的比求出未知溶液的浓度①准确测定反应过程中溶液的体积②准确判定滴定终点酸式滴定管、碱式滴定管锥形瓶、铁架台、滴定管夹等标准溶液、待测液指示剂准备:洗涤、查漏、润洗、注液、调节、读数滴定:移动溶液、滴入指示剂、滴定、判断终点、读数计算:取两次或两次以上消耗标准溶液体积的平均值,依原理求算二、重点知识阐述与剖析1.电解质与非电解质用心爱心专心121号编辑2盐类水解计算方法规律应用强酸强碱弱酸弱碱表示方法单质不是电解质也不是非电解质;而化合物中如酸性氧化物(如SO2、CO2)、碱性气体(如NH3)是非电解质。虽然它们的水溶液能导电,但这是由于它们溶于水后与水发生化学反应生成的酸电离出自由移动离子的缘故,它们本身不能电离出自由移动的离子,所以它们是非电解质。酸、碱、盐和大部分金属氧化物是电解质。2.强电解质和弱电解质强酸、强碱、大多数盐和某些金属氧化物是强电解质。电解质的强弱与它的溶解性无关,即使那些不溶于水的盐如BaSO4也是强电解质,因为溶解部分完全电离。某些金属氧化物虽然在水溶液中不能电离(有的与水反应),但它们在熔化状态下一般能完全电离成自由移动的离子,因而它们也是强电解质。3.水的电离和溶液的酸碱性水是极弱的电解质,在水溶液中存在着水的电离平衡H2OH++OH-,当溶液中加入酸或碱(包括弱酸、弱碱)时,酸碱电离出的H+或OH-会抑制水的电离。常温下,水的离子积常数KW=1×10-14,它与溶解的酸碱性无关。在酸溶液中,KW≈c(H+)酸·c(OH-)水;在碱溶液中,KW≈c(H+)水·c(OH-)碱;在不水解的盐溶液中,KW=c(H+)水·c(OH-)水。三、典型例题选讲【例1】在溶液导电性测定装置中盛有饱和石灰水,不断通入CO2时,电流强度随时间变化的曲线正确的是(假设溶液体积不变)【解析】电解质溶液的导电性与溶液中离子浓度大小和离子电荷数多少有关,离子浓度越大,离子所带电荷数越多,溶液的导电性越强(电流强度越大,电阻越小)。把CO2通入石灰水中,发生反应的离子方程式为:Ca2++2OH-+CO2==CaCO3↓+H2O(离子浓度减小,导电性减弱),CO2+CaCO3+H2O==Ca2++2HCO3-(...