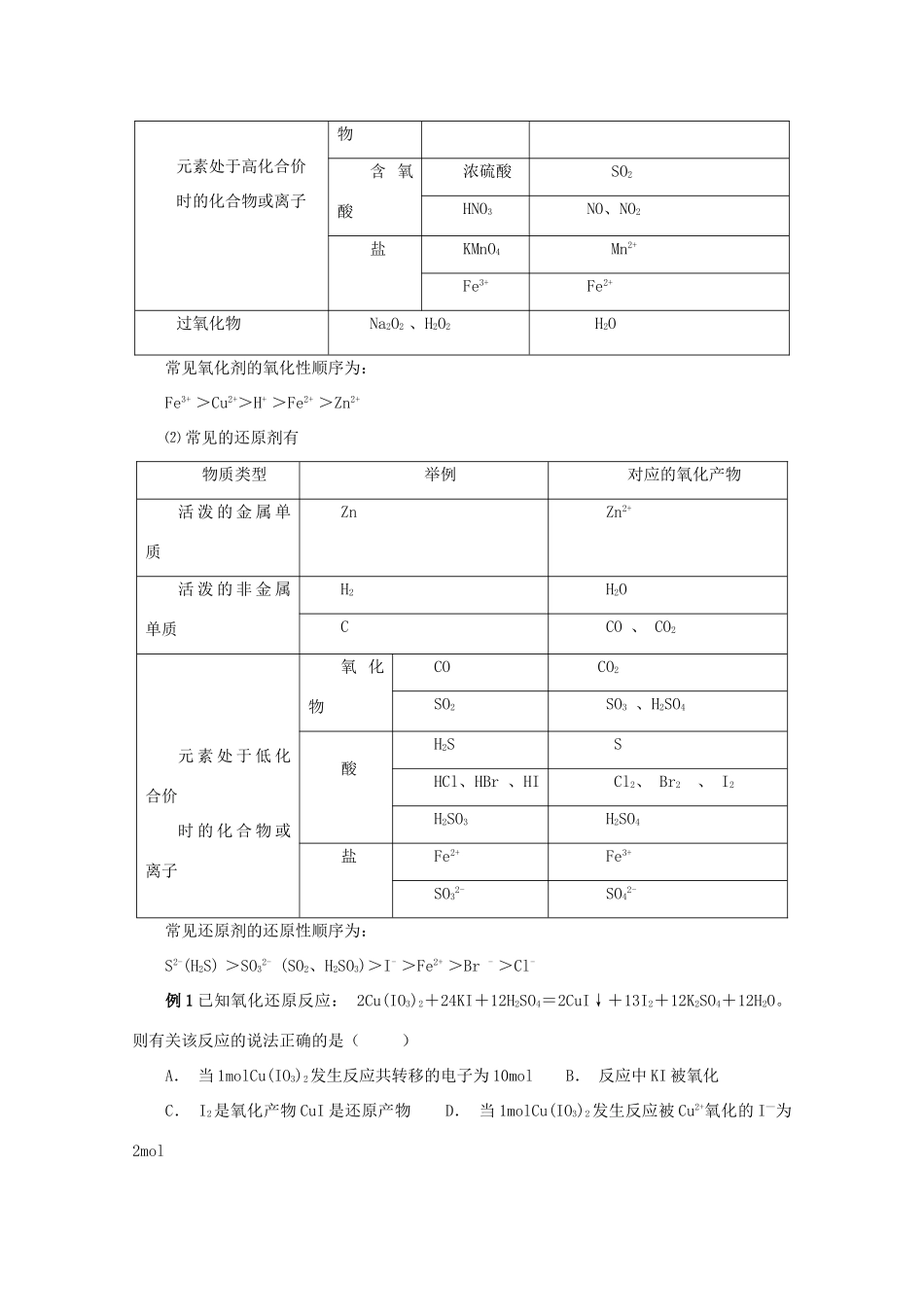
专题06氧化还原反应一、氧化还原反应基本概念1.概念本质:凡有电子得失或共用电子对偏移的一类反应称氧化还原反应,得失电子数相等。特征:是反应前后有元素化合价发生变化的反应。2.氧化还原反应电子转移的表示方法①双线桥法:②单线桥法:3.重要的氧化剂和还原剂物质在反应中是作氧化剂还是作还原剂,表观上可通过元素的化合价来判断。一般来说,元素处于最高化合价时,只能作为氧化剂;元素处于最低化合价时,只能作还原剂;元素处于中间化合价时,既可作氧化剂,也可作还原剂。⑴常见的氧化剂物质类型举例对应的还原产物活泼的非金属单质X2(卤素)X-O2O2-、H2O、OH-氧化MnO2Mn2+元素处于高化合价时的化合物或离子物含氧酸浓硫酸SO2HNO3NO、NO2盐KMnO4Mn2+Fe3+Fe2+过氧化物Na2O2、H2O2H2O常见氧化剂的氧化性顺序为:Fe3+>Cu2+>H+>Fe2+>Zn2+⑵常见的还原剂有物质类型举例对应的氧化产物活泼的金属单质ZnZn2+活泼的非金属单质H2H2OCCO、CO2元素处于低化合价时的化合物或离子氧化物COCO2SO2SO3、H2SO4酸H2SSHCl、HBr、HICl2、Br2、I2H2SO3H2SO4盐Fe2+Fe3+SO32-SO42-常见还原剂的还原性顺序为:S2-(H2S)>SO32-(SO2、H2SO3)>I->Fe2+>Br->Cl-例1已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O。则有关该反应的说法正确的是()A.当1molCu(IO3)2发生反应共转移的电子为10molB.反应中KI被氧化C.I2是氧化产物CuI是还原产物D.当1molCu(IO3)2发生反应被Cu2+氧化的I—为2mol例2已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是A.S2Cl2中S的化合价为-2B.H2O作还原剂C.每生成1molSO2转移3mol电子D.氧化产物与还原产物物质的量比为3∶1【答案】C【解析】A.由化合物中正负化合物的代数和为零可知,S2Cl2中氯元素化合价为-1,则硫元素的化合价为+1,故A说法错误;B.在该反应中,H2O中的氢和氧的化合价反应前后均没有发生变化,故H2O既不是氧化剂,也不是还原剂,故B说法错误;C.在该反应中硫元素的化合价由+1价上升到+4价,则每生成1molSO2转移3mol电子,故C说法正确;D.在该反应中氧化产物是SO2,还原产物是S,二者的物质的量之比是1︰3,故D说法错误。二、氧化性、还原性强弱的判断方法和依据氧化性→得电子性(填“得”或“失”),得到电子越容易→氧化性越强;还原性→失电子性(填“得”或“失”),失去电子越容易→还原性越强。与得失电子的多少无关。如:还原性:Na>Mg>Al,氧化性:浓HNO3>稀HNO31.根据元素在周期表中的位置同周期元素:从左至右,金属性(还原性)逐渐减弱,非金属性(氧化性)逐渐增强;同主族元素:从上至下,金属性(还原性)逐渐增强,非金属性(氧化性)逐渐减弱。2.根据金属活动顺序3.根据非金属活动顺序非金属的活动顺序一般为:FOClBrIS氧化性逐渐减弱;F—O2—Cl—Br—I—S2—还原性逐渐增强。4.依据反应式中的反应物和生成物之间的关系氧化剂的氧化性>氧化产物的氧化性还原剂的还原性>还原产物的还原性5.氧化性、还原性的强弱与温度、浓度、酸碱性的关系⑴温度:升高温度,氧化剂的氧化性增强,还原剂的还原性也增强。如:热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。若不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)发生反应时,所需温度高低不同,则温度低的氧化性(或还原性)强,反之则弱。例:已知MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O4HCl+O22Cl2+2H2O,则KMnO4、MnO2、O2氧化性强弱的顺序为:KMnO4>MnO2>O2⑵浓度一般情况下,同种氧化剂(或还原剂)浓度越大,氧化性(或还原性)越强。如:浓硝酸的氧化性比稀硝酸强;浓H2SO4的氧化性比稀H2SO4强;浓盐酸还原MnO2生成氯气,而稀盐酸不与MnO2反应,说明还原性:浓盐酸>稀盐酸。⑶酸碱性溶液的酸性增强,氧化剂的氧化性增强,很多氧化剂在酸性溶液中能氧化某些物质,在中性溶液中就不一定能氧化了。如:中性环境中NO3-不显氧化性,酸性环境中NO3-显氧化性;KMnO4、KClO3能氧化浓HCl中的Cl-,而不能在NaCl溶液中氧化Cl-;KMnO4氧化Fe2+也要...