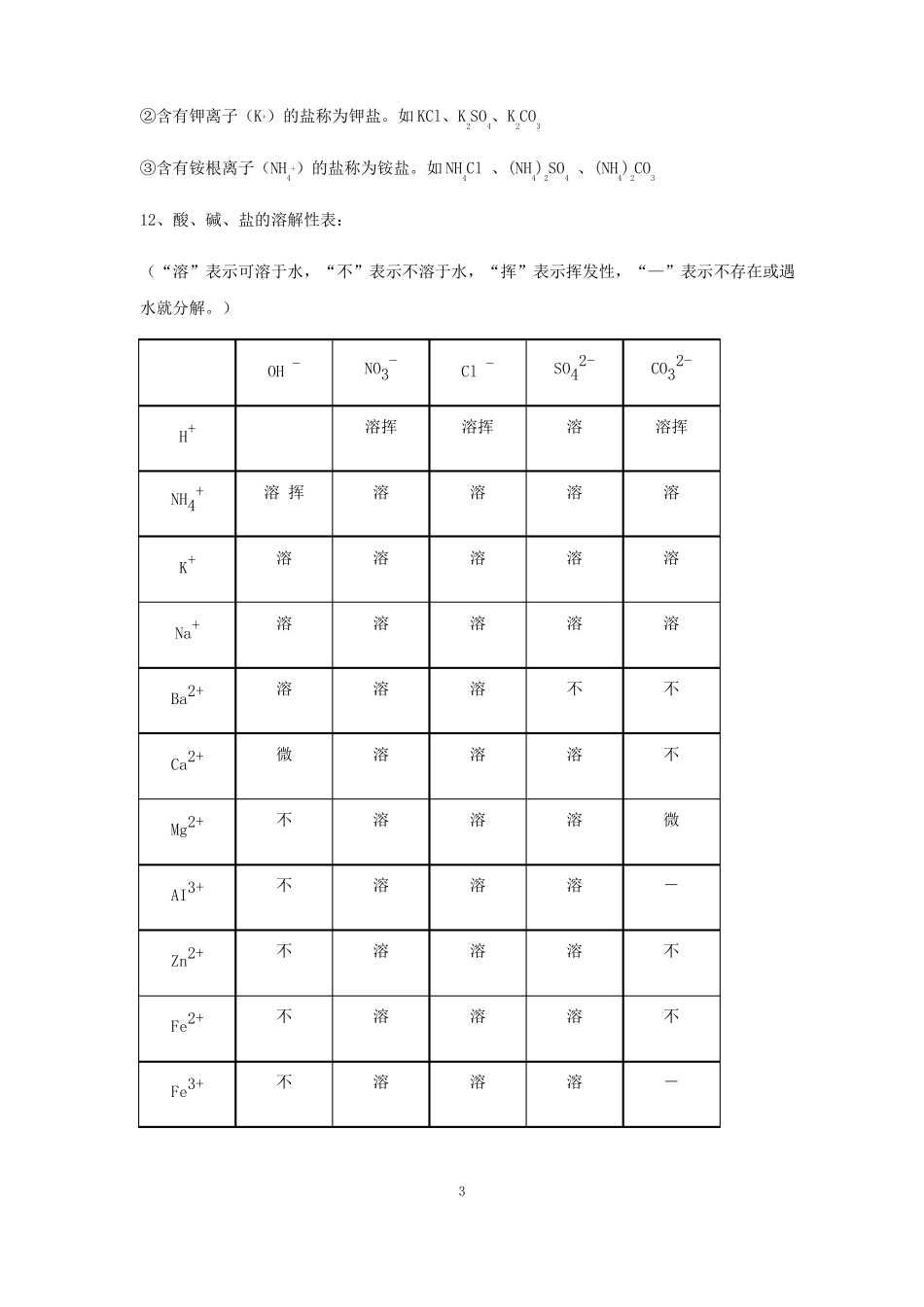
第十一单元盐与化学肥料课题1盐1、食盐是盐,是正确的。因为食盐是由Na和Cl组成的化合物;盐就是食盐,这种说法是错误的。因为盐是由金属离子和酸根离子组成的一类化合物。例如:Na2CO3、KCl等都是盐。工业用盐如亚硝酸钠(NaNO2,有毒)误作食盐用于烹调而引起中毒事件。2、粗盐提纯实验可能出现误差的原因:①粗盐的两次称量数值不准确;②对粗盐的不再溶解判断不准确;③过滤中的操作失误,比如粗盐溶液的损失、过滤不充分、滤渣的洗涤不充分、滤液倾倒不彻底等;④蒸发中滤液未全部蒸干,局部过热液滴飞溅等;⑤蒸发后的固体转移不彻底、称量有误、计算有误等。偏低的原因:①没有洗涤沉淀;②食盐没有完全溶解等。3、蒸发时应注意的事项:①蒸发皿应放在铁圈上,用酒精灯加热。停止加热后,热的蒸发皿要用坩埚钳夹取,热的蒸发皿如需立即放在实验台上,要垫上石棉网,以免烫坏实验台。②蒸发溶液时要注意倒入蒸发皿里的溶液以不超过蒸发皿容积的2/3为宜,防止加热至沸腾时容易向外飞溅。③在加热过程中,用玻璃棒不断搅动,防止由于局部温度过高,造成液滴飞溅。④当蒸发皿中出现较多量的固体时,即停止加热,利用余热将剩余水分蒸发掉,以避免固体因受热而迸溅出来。。4、在溶解、过滤、蒸发操作中都用到了玻璃棒,分别所起的作用:①溶解:玻璃棒起搅拌加速溶解作用。②过滤:玻璃棒起引流作用。③蒸发:玻璃棒起搅拌,防止局部受热时液滴飞溅作用。④用玻璃棒把固体移到纸上,称量回收,玻璃棒作用:转移固体的工具。5、氯化钠化学式为NaCl,是易溶于水的白色固体,可作①调味料,腌制食品;②可制生理盐水;③融雪剂(氯化钠能使水的凝固点降低);④选种子。根据:氯化钠的溶解度受温度的影响不大,氯化钠可通过晾晒海水或者煮盐井水、盐湖水等,蒸发除去其水分,得到粗盐。粗盐中含有较多的可溶性杂质(如CaCl2、MgCl2)和不溶性杂质(如泥沙)。6、碳酸钠化学式为Na2CO3,是易溶于水的白色固体,水溶液呈碱性,俗名纯碱、苏打,可1+-用于①制洗涤剂②造纸、纺织、玻璃。7、碳酸氢钠化学式为NaHCO3,是易溶于水的白色固体,水溶液呈碱性。俗名小苏打,可用于①发酵粉②治疗胃酸过多症。8、碳酸钙化学式为CaCO3,是难溶于水的白色固体,是大理石、石灰石的主要成分。可用于①补钙剂②建筑材料9、碱性物质:包括碱和某些盐(如:Na2CO3属于盐,呈碱性);酸性物质包括酸和某些盐。10、盐的化学性质①盐与金属发生置换反应生成新盐和新金属。(金属:前换后,盐:可溶)Fe+CuSO4=FeSO4+Cu②盐与酸发生复分解反应生成新盐和新酸。盐+酸→另一种盐+另一种酸CaCO3+2HCl=CaCl2+H2O+CO2↑Na2CO3+2HCl=2NaCl+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑③盐与碱发生复分解反应生成新盐和新酸:盐+碱→另一种盐+另一种碱Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(制NaOH的方法)④盐与盐发生复分解反应生成两种新盐:盐1+盐2→新盐1+新盐2NaCl+AgNO3=AgCl↓+NaNO311、盐的分类:根据盐的组成里所含阴、阳离子的特点,可将盐分类并称为某盐。例如:①组成里含有碳酸根离子(CO3)的盐称为碳酸盐。如CaCO3、Na2CO3、MgCO32-2②含有钾离子(K)的盐称为钾盐。如KCl、K2SO4、K2CO3③含有铵根离子(NH4)的盐称为铵盐。如NH4Cl、(NH4)2SO4、(NH4)2CO312、酸、碱、盐的溶解性表:(“溶”表示可溶于水,“不”表示不溶于水,“挥”表示挥发性,“—”表示不存在或遇水就分解。)OH-NO3-溶挥Cl-溶挥SO42-溶CO32-溶挥++H+NH4+K+溶挥溶溶溶溶溶溶溶溶溶Na+溶溶溶溶溶Ba2+溶溶溶不不Ca2+微溶溶溶不Mg2+不溶溶溶微AI3+不溶溶溶-Zn2+不溶溶溶不Fe2+不溶溶溶不Fe3+不溶溶溶-3Cu2+不溶溶溶-Ag+-溶不微不13、酸、碱、盐的溶解性:①所学的酸都可溶;②溶碱有五种:钾钠钡钙铵。③凡钾钠铵硝酸盐都可溶;硫酸盐除硫酸钡(BaSO4)不溶;盐酸盐除氯化银(AgCl)不溶;碳酸盐钾钠铵可溶。理解:①酸:所学的都可溶;②“溶碱有五种:钾钠钡钙铵”(只有氢氧化钾、氢氧化钠、氢氧化钡、氢氧化钙、氨水可溶于水,其余均为沉淀);③盐:凡钾钠铵硝酸盐都可溶;〔硫酸盐除硫酸钡(BaSO4)不溶,其余多数可溶〕;盐酸...