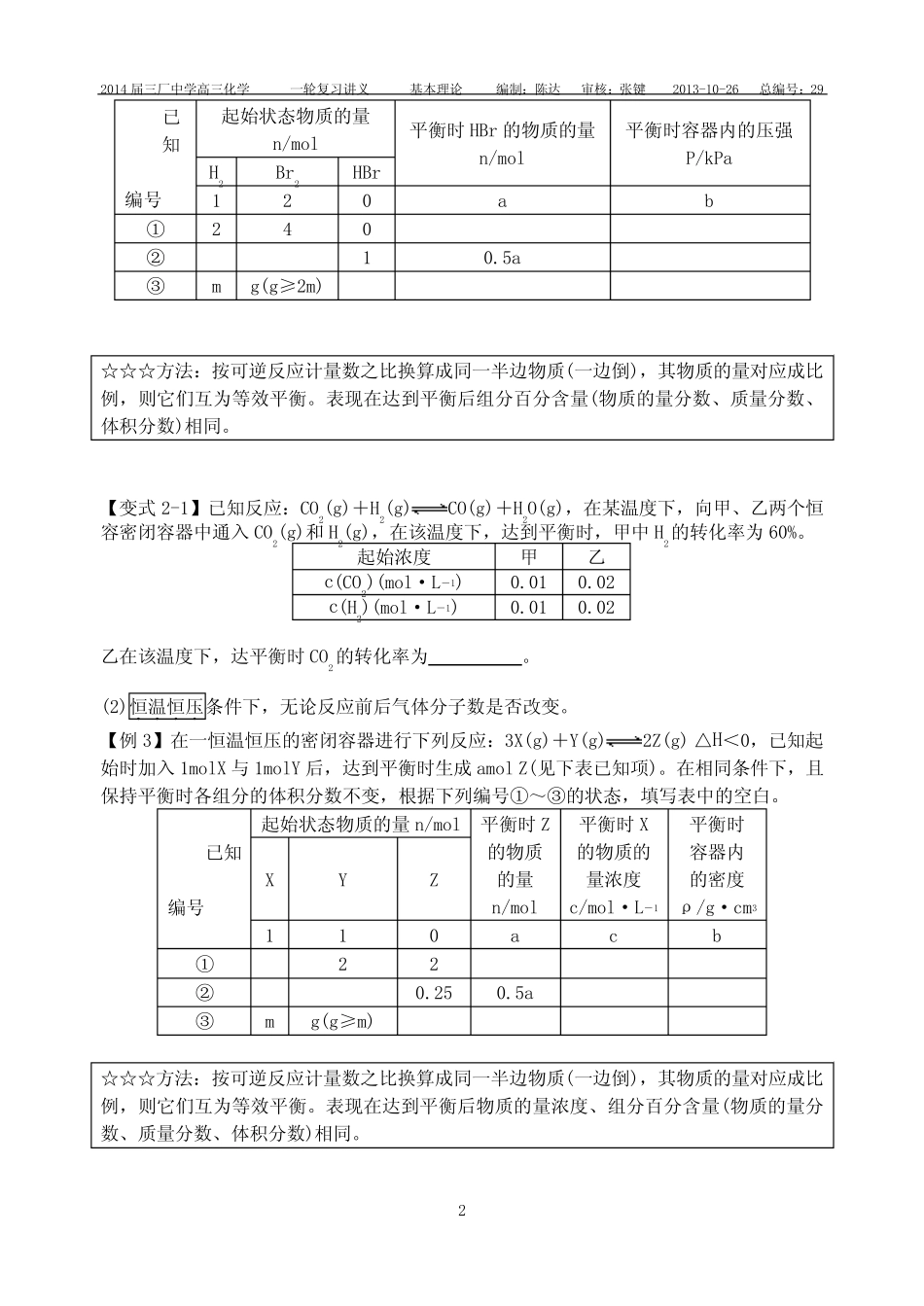
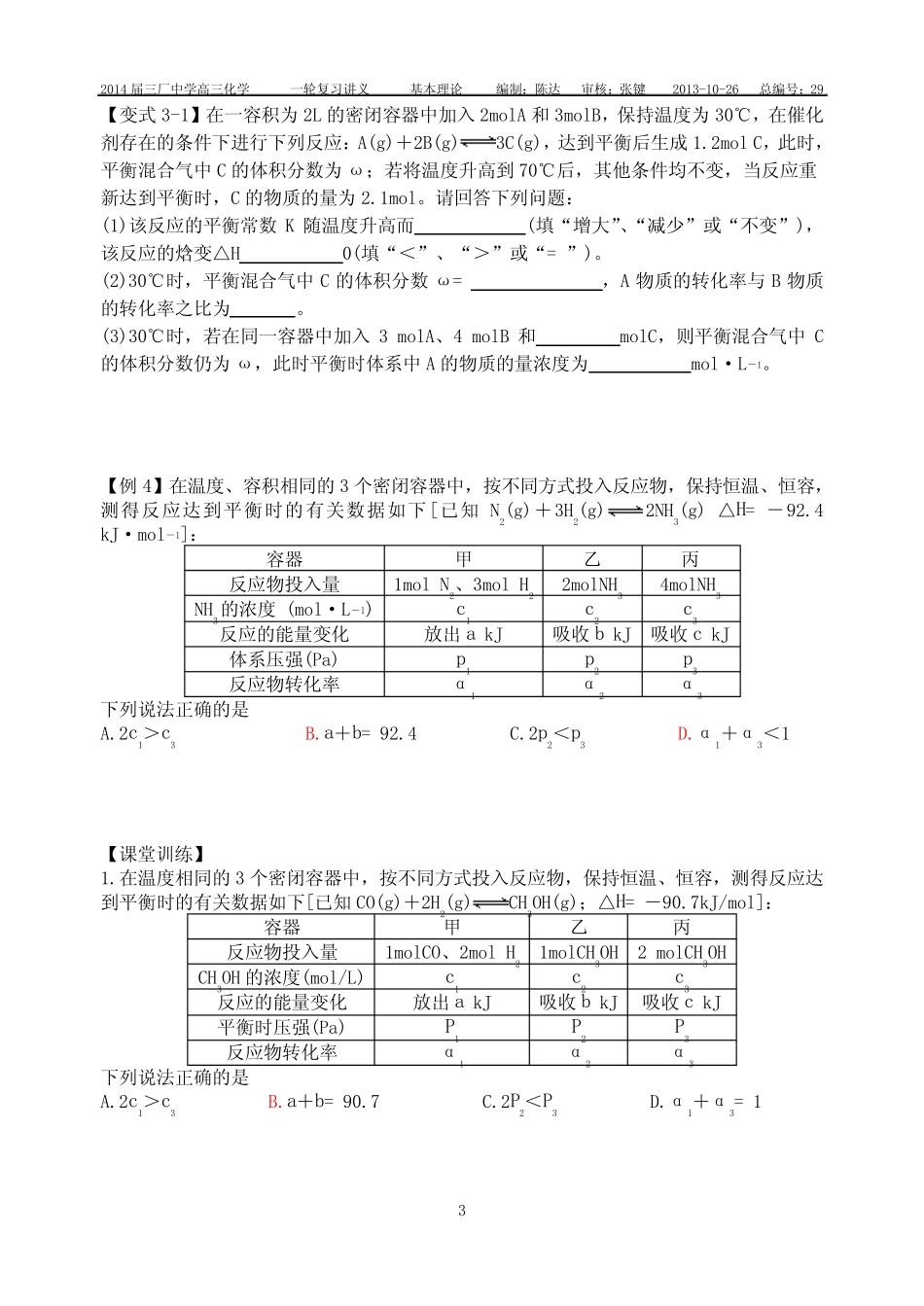
2014届三厂中学高三化学一轮复习讲义基本理论编制:陈达审核:张键2013-10-26总编号:291专题十一化学反应速率与化学平衡第三课时等效平衡【课堂目标】1.建立等效平衡的观点,理解等效平衡的特征;2.会利用等效平衡的思想解答题目。【知识网络】【基础梳理】活动一:等效平衡的建立1.任何情况下的完全等效——投料相等【例1】常温常压下,可逆反应2SO2(g)+O2(g)2SO3(g)在一密闭容器中进行,起始物质分别如下:2SO2(g)+O2(g)2SO3(g)起始:2mol1mol0mol①0mol0molmol②0.5mol0.25molmol☆☆☆方法:通过方程式的化学计量数换算成同一侧的物质后,各物质的量对应相等,则两平衡等效。表现在达到平衡后物质的量、质量、体积、物质的量浓度、组分百分含量(物质的量分数、质量分数、体积分数)相同。【变式1】某温度下,在2L密闭容器中加入1molN2和3molH2,发生N2(g)+3H2(g)2NH3(g)反应,达到平衡,测得平衡混合气体中N2、H2、NH3物质的量分别为mmol、nmol、gmol。如温度不变,只改变初始加入的物质的量,而要求m、n、g的值维持不变,则N2、H2、NH3加入的物质的量用x、y、z表示时,应满足条件:(1)若x=0,y=0,则z=。(2)若x=0.75mol,则y=,z=。(3)x、y、z应满足的一般条件是(请用两个方程式表示,其中一个含x和y,另一个只含y和z)、。2.有条件的部分等效——投料比.相等(1)恒温恒容....条件下,对于反应前后气体分子数不变..的可逆反应。【例2】在一恒温恒容的密闭容器进行下列反应:H2(g)+Br2(g)2HBr(g),已知起始时加入1molH2与2molBr2后,达到平衡时生成amolHBr(见下表已知项)。在相同条件下,且保持平衡时各组分的体积分数不变,根据下列编号①~③的状态,填写表中的空白。已知:2014届三厂中学高三化学一轮复习讲义基本理论编制:陈达审核:张键2013-10-26总编号:292已知编号起始状态物质的量n/mol平衡时HBr的物质的量n/mol平衡时容器内的压强P/kPaH2Br2HBr120ab①240②10.5a③mg(g≥2m)☆☆☆方法:按可逆反应计量数之比换算成同一半边物质(一边倒),其物质的量对应成比例,则它们互为等效平衡。表现在达到平衡后组分百分含量(物质的量分数、质量分数、体积分数)相同。【变式2-1】已知反应:CO2(g)+H2(g)CO(g)+H2O(g),在某温度下,向甲、乙两个恒容密闭容器中通入CO2(g)和H2(g),在该温度下,达到平衡时,甲中H2的转化率为60%。起始浓度甲乙c(CO2)(mol·L-1)0.010.02c(H2)(mol·L-1)0.010.02乙在该温度下,达平衡时CO2的转化率为。(2)恒温恒压....条件下,无论反应前后气体分子数是否改变。【例3】在一恒温恒压的密闭容器进行下列反应:3X(g)+Y(g)2Z(g)△H<0,已知起始时加入1molX与1molY后,达到平衡时生成amolZ(见下表已知项)。在相同条件下,且保持平衡时各组分的体积分数不变,根据下列编号①~③的状态,填写表中的空白。已知编号起始状态物质的量n/mol平衡时Z的物质的量n/mol平衡时X的物质的量浓度c/mol·L-1平衡时容器内的密度ρ/g·cm3XYZ110acb①22②0.250.5a③mg(g≥m)☆☆☆方法:按可逆反应计量数之比换算成同一半边物质(一边倒),其物质的量对应成比例,则它们互为等效平衡。表现在达到平衡后物质的量浓度、组分百分含量(物质的量分数、质量分数、体积分数)相同。2014届三厂中学高三化学一轮复习讲义基本理论编制:陈达审核:张键2013-10-26总编号:293【变式3-1】在一容积为2L的密闭容器中加入2molA和3molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)3C(g),达到平衡后生成1.2molC,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1mol。请回答下列问题:(1)该反应的平衡常数K随温度升高而(填“增大”、“减少”或“不变”),该反应的焓变△H0(填“<”、“>”或“=”)。(2)30℃时,平衡混合气中C的体积分数ω=,A物质的转化率与B物质的转化率之比为。(3)30℃时,若在同一容器中加入3molA、4molB和molC,则平衡混合气中C的体积分数仍为ω,此时平衡时体系中A的物质的量浓度为mol·L-1。【例4】在温度、容积相同的3个密闭容器中,按不同方式投入...