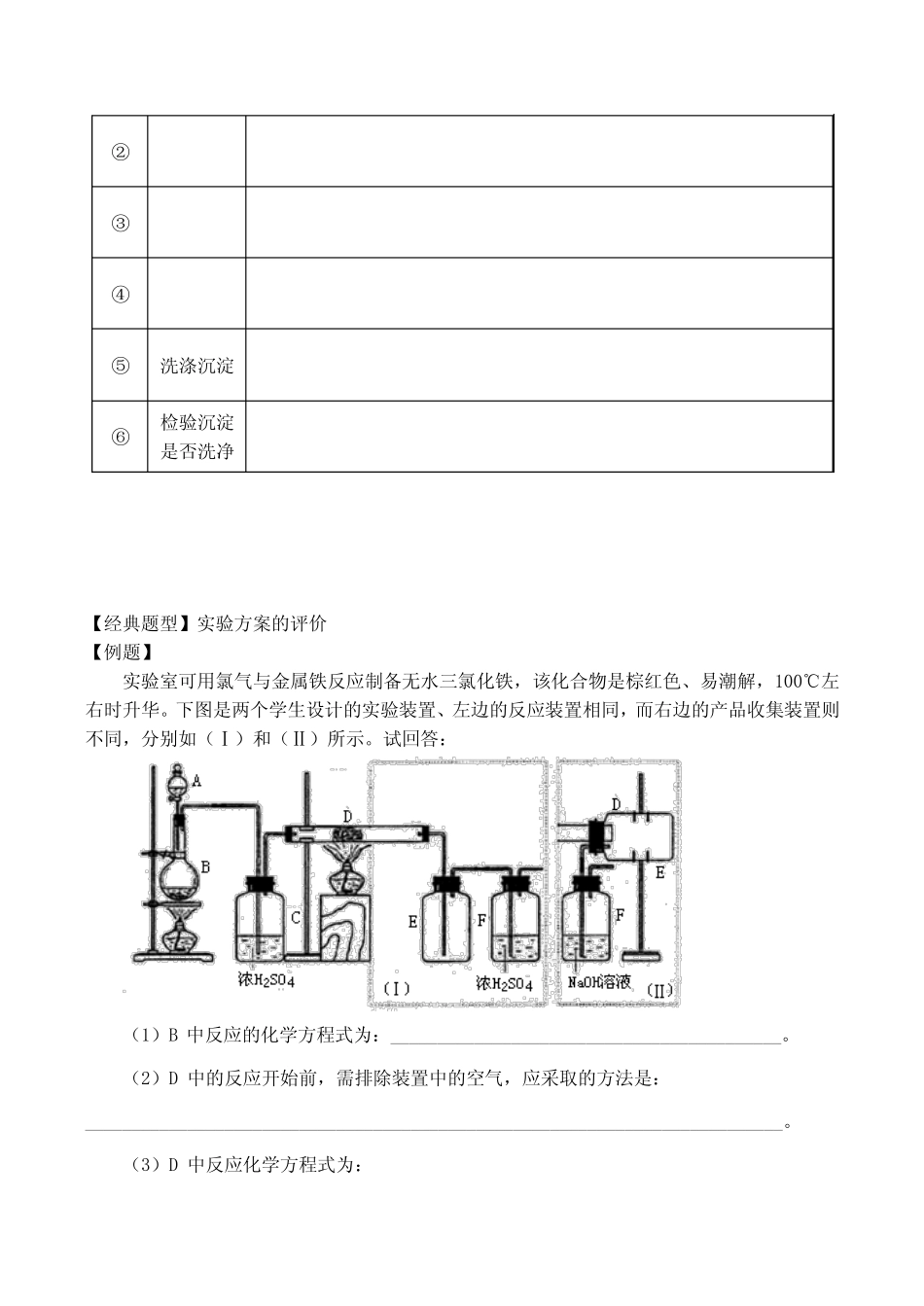
2008高考化学专题复习17化学实验设计与评价【专题目标】1.根据实验试题要求,设计基本实验方案。2.运用化学实验知识,对实验方案作出分析和判断。【经典题型】实验方案的设计【例题】Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂。简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O。【点拔】CuO经氢气还原所得到的红色产物一定有铜,要检验铜中是否含有Cu2O,应运用Cu2O具有而铜不具有的性质去判断。根据题中所给信息,显然应将Cu2O在酸性溶液中转变为Cu2+,从颜色变化来判断。但Cu也能与氧化性酸反应可转变为Cu2+,故不应使用浓硫酸、浓稀硝酸。【规律总结】实验设计的一般步骤1.根据试题要求,分析所给信息,选择并确定实验原理。2.根据实验原理,确定药品、选择仪器,提出实验方案。3.分析实验成败关键,修改完善实验程序。【巩固】1.硅及其化合物用途非常广泛。常用作干燥剂的多孔硅胶是由硅酸盐(例如Na2SiO3)的水溶液中加入相应的酸生成溶解度较小的硅酸分子,放置一段时间后,硅酸分子逐渐聚合生成硅酸溶胶,进一步处理可得多孔硅胶。多孔硅胶对许多气体如乙醚蒸气等有吸附作用,设计一个实验,证明硅胶的吸附性,写出实验的步骤、现象及解释。2.已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)请填写表中空格,完成由上述混合物得到固体甲的实验设计。序号实验步骤简述实验操作(不必叙述如何组装实验装置)①溶解将混合物放入烧杯中,加入98%H2SO4,充分搅拌直到固体不再溶解。②③④⑤洗涤沉淀⑥检验沉淀是否洗净【经典题型】实验方案的评价【例题】实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:(1)B中反应的化学方程式为:__________________________________________。(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:___________________________________________________________________________。(3)D中反应化学方程式为:___________________________________________________________________________。(4)装置(Ⅰ)的主要缺点是:___________________________________________________________________________。(5)装置(Ⅱ)的主要缺点是:___________________________________________________________________________。如果选用此装置来完成实验,则必须采取的改进措施是:___________________________________________________________________________。【点拔】氯气与金属铁反应生成三氯化铁,而该物质易潮解,故应避免与水(水蒸气)接触。该物质100℃左右时升华,则温度低于100℃时为固体,易堵塞仪器的细口部分。Cl2有毒,不应直接排入空气中,应进行尾气处理。【规律总结】实验评价试题的几种类型1.评价实验原理2.评价实验方法3.评价药品、仪器4.评价实验现象和结论【巩固】1.三位同学分别设计了以下三个检验SO42-的实验方案:方案甲:试液+BaCl2溶液→白色沉淀→足量稀HNO3→沉淀不溶解方案乙:试液+足量稀HCl→无沉淀+BaCl2溶液→白色沉淀方案丙:试液+足量稀HNO3→无沉淀+Ba(NO3)2→白色沉淀试评价上述多种方案是否严密?分别说明理由。2.选择使用下图中的仪器(含药品),验证由铜和适量浓硝酸反应产生的气体中含有NO。(N2和O2的用量可自由控制)。已知①NO+NO2+2OH-=2NO2-+H2O②气体液化温度:NO2:21℃,NO:-152℃(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器连接顺序表示)。甲:A→C→F→D→B乙:A→B→C→E丙:A→E→D→B甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不...