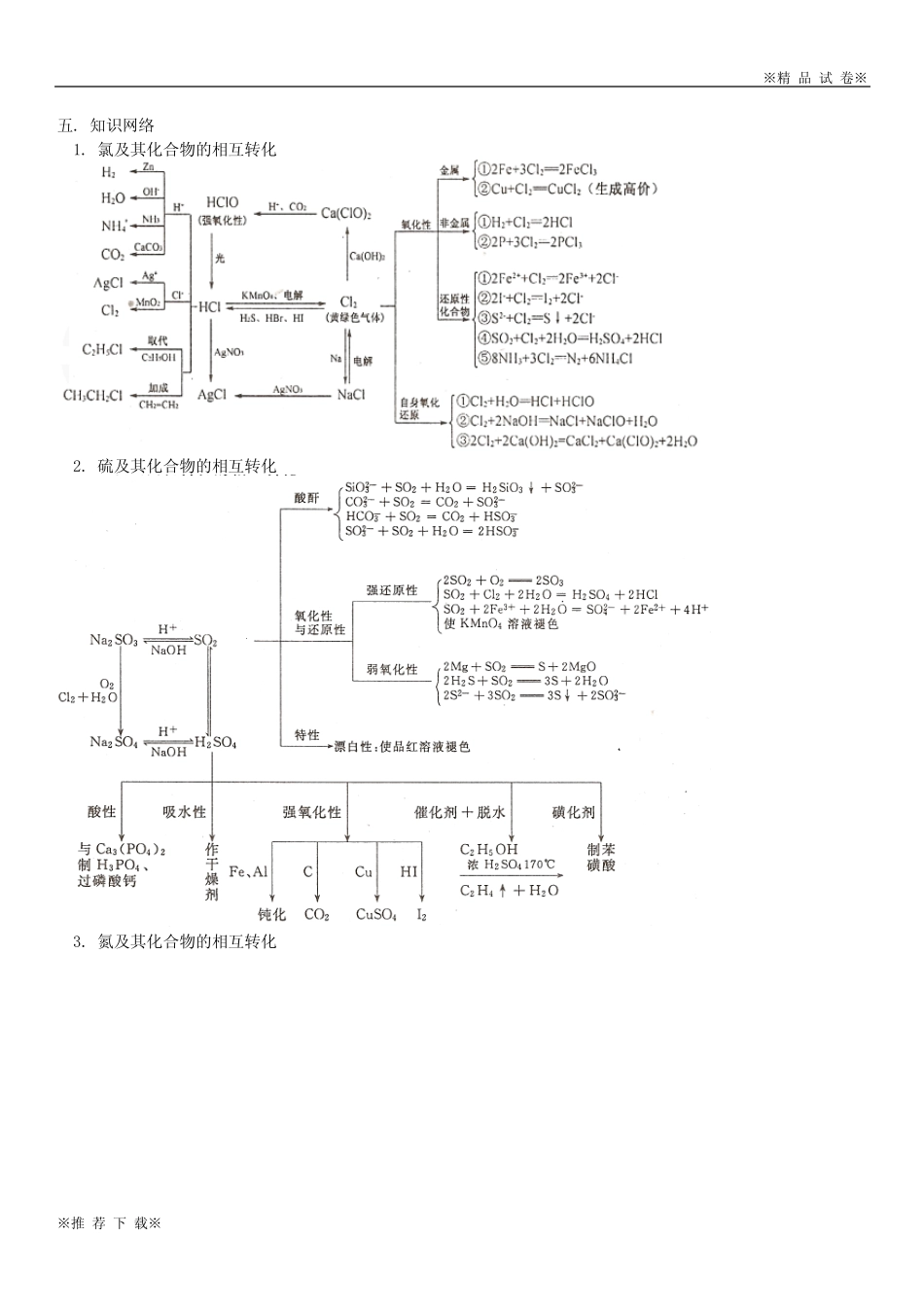
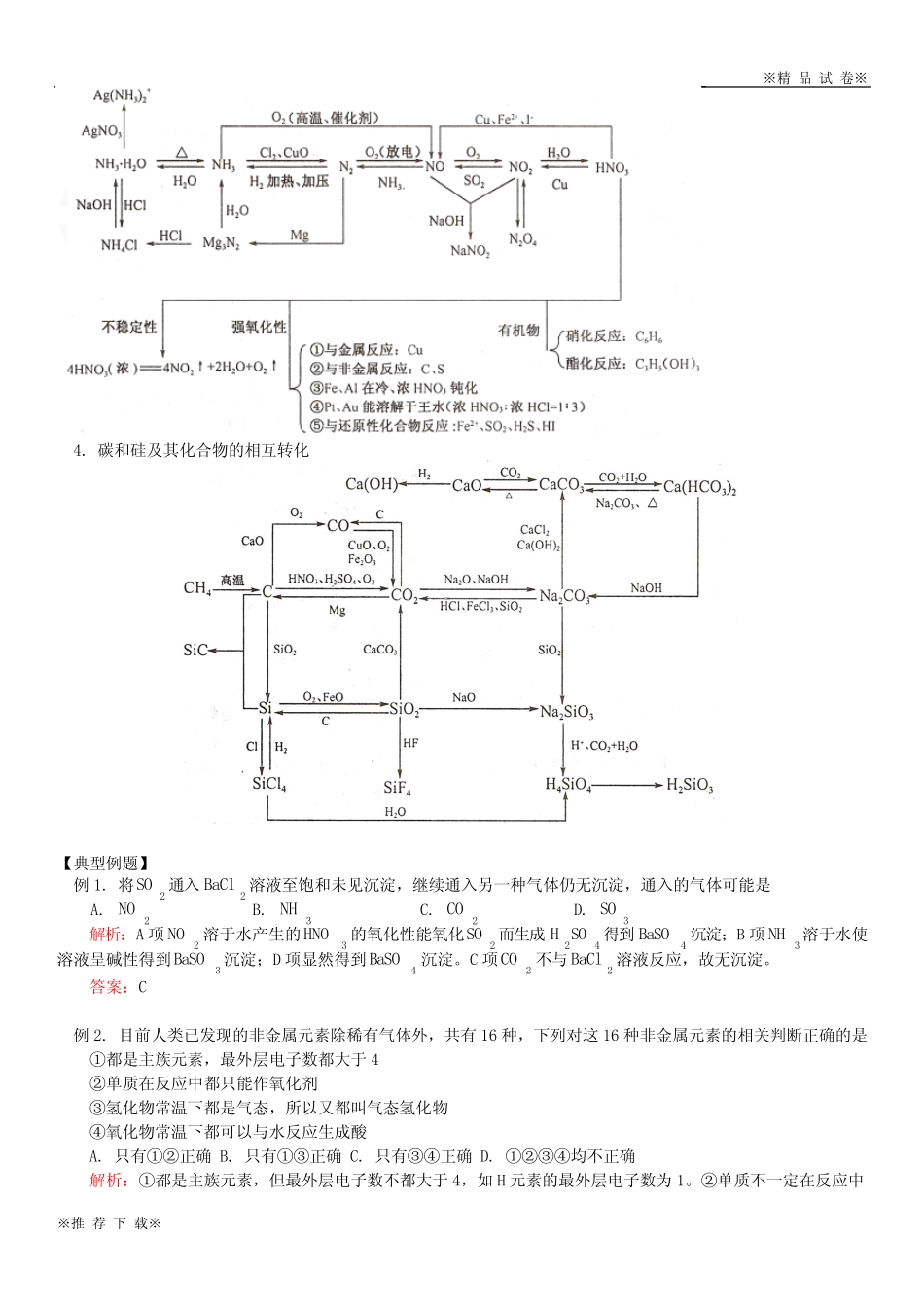
※精品试卷※※推荐下载※氯、硫、氮、碳、硅等非金属及其重要化合物的化学性质【本讲教育信息】一.教学内容:高考第二轮复习《专题7》二.教学目的:1.了解氯、氮、硫、硅等非金属及其重要化合物的主要物理性质。2.了解氯气的氧化性(与氢气、钠、铁、某些盐等的反应)及与水、碱的反应,知道氯水的消毒和漂白原理。了解硫的可燃性和氮气的稳定性。知道硅元素在自然界以2SiO及硅酸盐的形式存在,知道晶体硅是良好的半导体材料。能说出氯、氮、硫、硅等非金属单质的主要用途。3.了解二氧化硫与氧气、与水的反应,认识亚硫酸的不稳定性,认识二氧化硫的漂白作用与次氯酸漂白作用的区别,了解二氧化氮与水的反应,了解二氧化硅与氢氟酸、与碱性氧化物、与强碱的反应。4.了解氨气与水、与酸的反应,了解氨水的成分以及氨水的不稳定性。了解铵盐易溶于水、受热易分解、与碱反应等性质。5.了解次氯酸、浓硫酸、硝酸的强氧化性,了解浓硫酸、硝酸分别与Cu、C的反应。了解常温下铁、铝在浓硫酸、浓硝酸中的钝化现象。认识工业上生产硫酸、硝酸的反应原理。6.了解陶瓷、玻璃、水泥等硅酸盐产品的用途。7.认识非金属及其重要化合物在生产中的应用和对生态环境的影响。了解氮循环对生态平衡的重要作用。了解氮氧化物、二氧化硫等污染物的来源、性质和危害,体会化学对环境保护的重要意义,逐步形成可持续发展的思想。三.重点和难点:1.氯、硫、氮、碳、硅等非金属及其重要化合物的主要物理性质和化学性质。2.氯气的氧化性(与氢气、钠、铁、某些盐等的反应)及与水、碱的反应,氯水的消毒和漂白原理。硫的可燃性和氮气的稳定性。硅元素在自然界以2SiO及硅酸盐的形式存在,晶体硅是良好的半导体材料。氯、氮、硫、硅等非金属单质的主要用途。3.二氧化硫与氧气、与水的反应,亚硫酸的不稳定性,二氧化硫的漂白作用与次氯酸漂白作用的区别,二氧化氮与水的反应,二氧化硅与氢氟酸、与碱性氧化物、与强碱的反应。4.氨气与水、与酸的反应,氨水的成分以及氨水的不稳定性。铵盐易溶于水、受热易分解、与碱反应等性质。5.次氯酸、浓硫酸、硝酸的强氧化性,浓硫酸、硝酸分别与Cu、C的反应。常温下铁、铝在浓硫酸、浓硝酸中的钝化现象。工业上生产硫酸、硝酸的反应原理。6.陶瓷、玻璃、水泥等硅酸盐产品的用途。非金属及其重要化合物在生产中的应用和对生态环境的影响。氮循环对生态平衡的重要作用。氮氧化物、二氧化硫等污染物的来源、性质和危害,化学对环境保护的重要意义。四.考点分析本专题内容在高考中的主要考查点是:1.氯、硫、氮、碳、硅等非金属及其重要化合物的主要物理性质和化学性质。2.氯气的氧化性(与氢气、钠、铁、某些盐等的反应)及与水、碱的反应,氯水的消毒和漂白原理。硫的可燃性和氮气的稳定性。硅元素在自然界以2SiO及硅酸盐的形式存在,晶体硅是良好的半导体材料。氯、氮、硫、硅等非金属单质的主要用途。3.二氧化硫与氧气、与水的反应,亚硫酸的不稳定性,二氧化硫的漂白作用与次氯酸漂白作用的区别,二氧化氮与水的反应,二氧化硅与氢氟酸、与碱性氧化物、与强碱的反应。4.氨气与水、与酸的反应,氨水的成分以及氨水的不稳定性。铵盐易溶于水、受热易分解、与碱反应等性质。5.次氯酸、深硫酸、硝酸的强氧化性,浓硫酸、硝酸分别与Cu、C的反应。常温下铁、铝在浓硫酸、浓硝酸中的钝化现象。工业上生产硫酸、硝酸的反应原理。※精品试卷※※推荐下载※五.知识网络1.氯及其化合物的相互转化2.硫及其化合物的相互转化3.氮及其化合物的相互转化※精品试卷※※推荐下载※4.碳和硅及其化合物的相互转化【典型例题】例1.将2SO通入2BaCl溶液至饱和未见沉淀,继续通入另一种气体仍无沉淀,通入的气体可能是A.2NOB.3NHC.2COD.3SO解析:A项2NO溶于水产生的3HNO的氧化性能氧化2SO而生成42SOH得到4BaSO沉淀;B项3NH溶于水使溶液呈碱性得到3BaSO沉淀;D项显然得到4BaSO沉淀。C项2CO不与2BaCl溶液反应,故无沉淀。答案:C例2.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断正确的是①都是主族元素,最外层电子数都大于4②单质在反应中都只能作氧化剂...