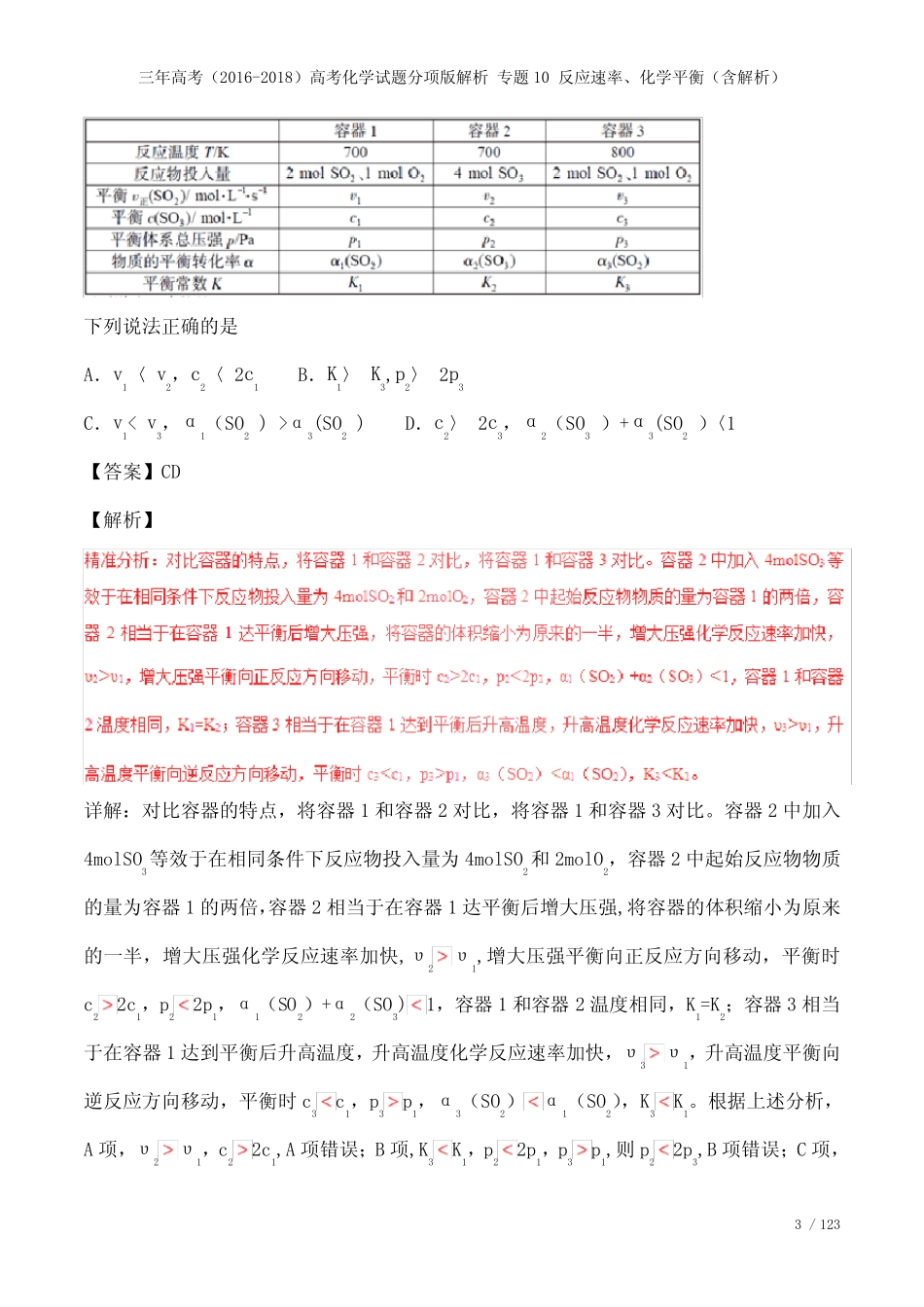
三年高考(2016-2018)高考化学试题分项版解析专题10反应速率、化学平衡(含解析)1/121三年高考(2016-2018)高考化学试题分项版解析专题10反应速率、化学平衡(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(三年高考(2016-2018)高考化学试题分项版解析专题10反应速率、化学平衡(含解析))的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为三年高考(2016-2018)高考化学试题分项版解析专题10反应速率、化学平衡(含解析)的全部内容。三年高考(2016-2018)高考化学试题分项版解析专题10反应速率、化学平衡(含解析)2/122专题10反应速率、化学平衡1.【2018天津卷】室温下,向圆底烧瓶中加入1molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBrC2H5Br+H2O,充分反应后达到平衡.已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78。5℃。下列有关叙述错误的是A.加入NaOH,可增大乙醇的物质的量B.增大HBr浓度,有利于生成C2H5BrC.若反应物增大至2mol,则两种反应物平衡转化率之比不变D.若起始温度提高至60℃,可缩短反应达到平衡的时间【答案】D【解析】考点定位:考查勒夏特列原理。【试题点评】易错提醒:本题的易错点是选项D,学生认为升高温度,化学反应速率加快,缩短大达到平衡的时间,但忽略了氢溴酸易挥发,升高温度时,HBr挥发除去,降低反应物的浓度,化学反应速率可能降低,延长化学反应达到平衡的时间。因此分析时,不能硬套结论,还要注意实际问题。2.【2018江苏卷】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)2SO3(g)(正反应放热),测得反应的相关数据如下:三年高考(2016-2018)高考化学试题分项版解析专题10反应速率、化学平衡(含解析)3/123下列说法正确的是A.v1〈v2,c2〈2c1B.K1〉K3,p2〉2p3C.v1α3(SO2)D.c2〉2c3,α2(SO3)+α3(SO2)〈1【答案】CD【解析】详解:对比容器的特点,将容器1和容器2对比,将容器1和容器3对比。容器2中加入4molSO3等效于在相同条件下反应物投入量为4molSO2和2molO2,容器2中起始反应物物质的量为容器1的两倍,容器2相当于在容器1达平衡后增大压强,将容器的体积缩小为原来的一半,增大压强化学反应速率加快,υ2υ1,增大压强平衡向正反应方向移动,平衡时c22c1,p22p1,α1(SO2)+α2(SO3)1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3υ1,升高温度平衡向逆反应方向移动,平衡时c3c1,p3p1,α3(SO2)α1(SO2),K3K1。根据上述分析,A项,υ2υ1,c22c1,A项错误;B项,K3K1,p22p1,p3p1,则p22p3,B项错误;C项,三年高考(2016-2018)高考化学试题分项版解析专题10反应速率、化学平衡(含解析)4/124υ3υ1,α3(SO2)α1(SO2),C项正确;D项,c22c1,c3c1,则c22c3,α1(SO2)+α2(SO3)1,α3(SO2)α1(SO2),则α2(SO3)+α3(SO2)1,D项正确;答案选CD。考点定位:本题主要考查了化学平衡状态的建立及其途径、影响化学反应速率和化学平衡的因素、有关化学平衡的计算等等。【试题点评】思路点拨:本题考查化学平衡时各物理量之间的关系,解题时巧妙设计中间状态(即建模),利用外界条件对化学反应速率和化学平衡的影响判断。如容器2先设计其完全等效平衡的起始态为4molSO2和2molO2,4molSO2和2molO2为两倍容器1中物质的量,起始物质的量成倍变化时相当于增大压强。3.【2017天津卷】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应.第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判...