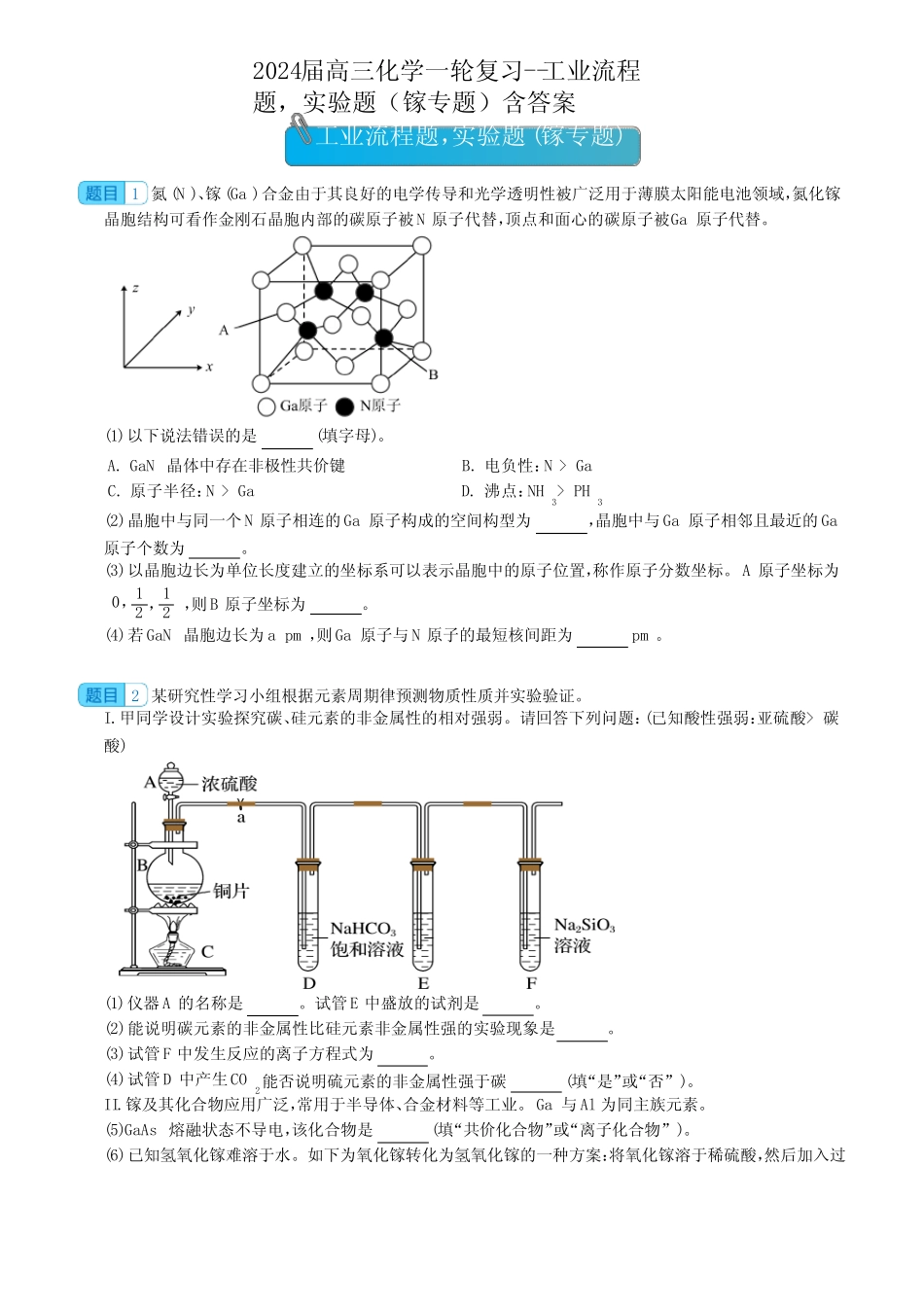
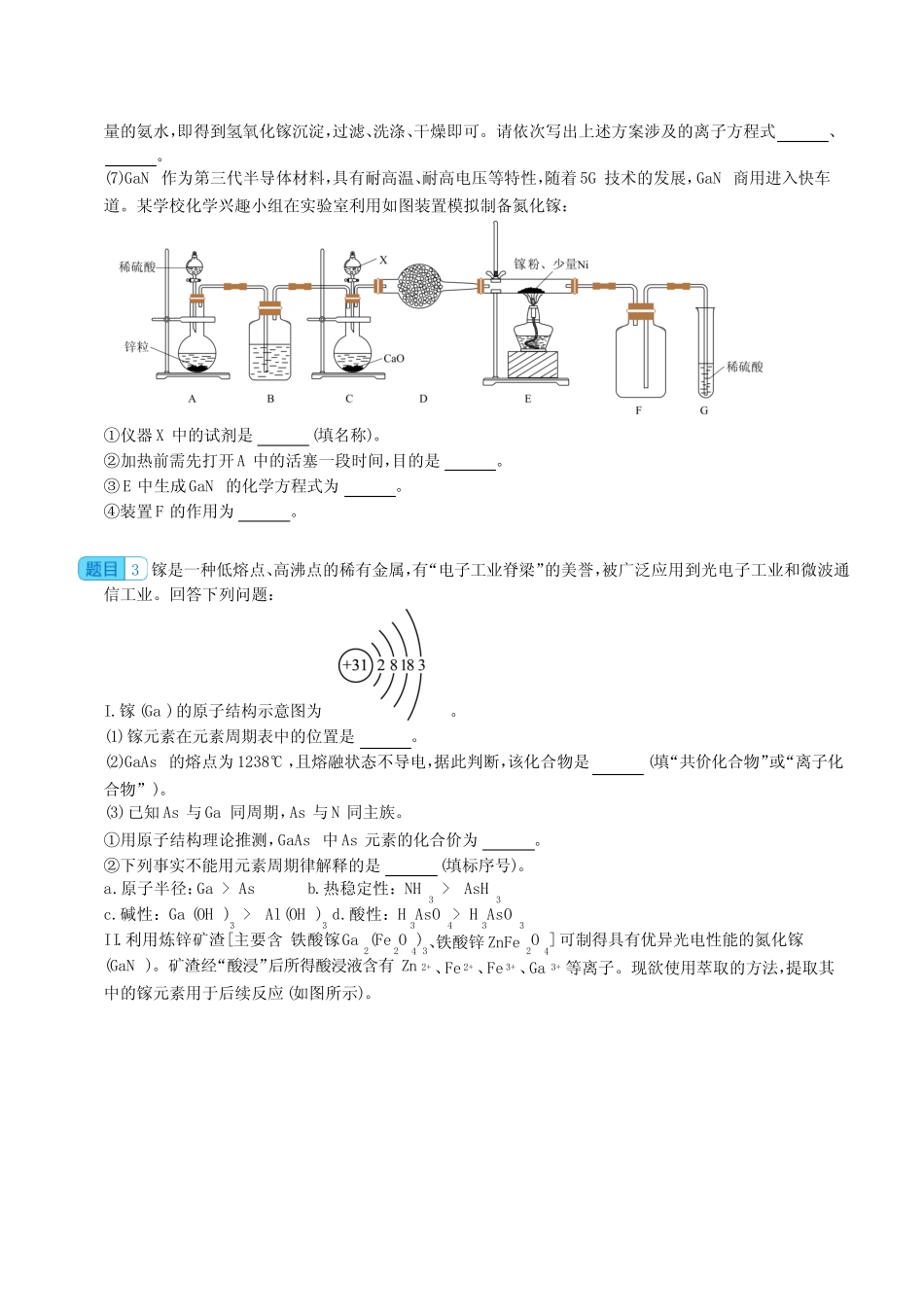
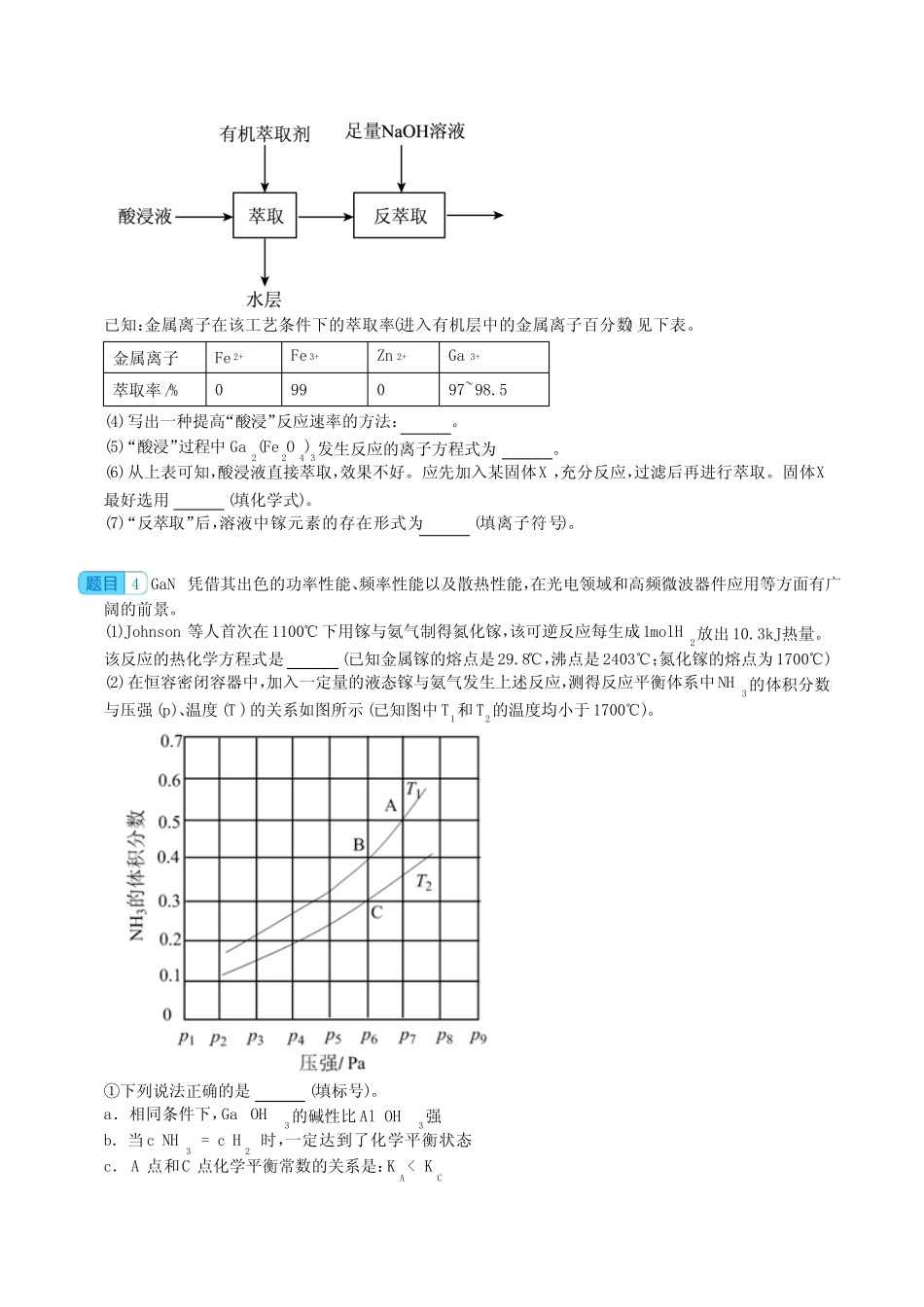
工业流程题,实验题(镓专题)1氮(N)、镓(Ga)合金由于其良好的电学传导和光学透明性被广泛用于薄膜太阳能电池领域,氮化镓晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。(1)以下说法错误的是(填字母)。A.GaN晶体中存在非极性共价键B.电负性:N>GaC.原子半径:N>GaD.沸点:NH3>PH3(2)晶胞中与同一个N原子相连的Ga原子构成的空间构型为,晶胞中与Ga原子相邻且最近的Ga原子个数为。(3)以晶胞边长为单位长度建立的坐标系可以表示晶胞中的原子位置,称作原子分数坐标。A原子坐标为0,12,12,则B原子坐标为。(4)若GaN晶胞边长为apm,则Ga原子与N原子的最短核间距为pm。2某研究性学习小组根据元素周期律预测物质性质并实验验证。I.甲同学设计实验探究碳、硅元素的非金属性的相对强弱。请回答下列问题:(已知酸性强弱:亚硫酸>碳酸)(1)仪器A的名称是。试管E中盛放的试剂是。(2)能说明碳元素的非金属性比硅元素非金属性强的实验现象是。(3)试管F中发生反应的离子方程式为。(4)试管D中产生CO2能否说明硫元素的非金属性强于碳(填“是”或“否”)。II.镓及其化合物应用广泛,常用于半导体、合金材料等工业。Ga与Al为同主族元素。(5)GaAs熔融状态不导电,该化合物是(填“共价化合物”或“离子化合物”)。(6)已知氢氧化镓难溶于水。如下为氧化镓转化为氢氧化镓的一种方案:将氧化镓溶于稀硫酸,然后加入过2024届高三化学一轮复习--工业流程题,实验题(镓专题)含答案量的氨水,即得到氢氧化镓沉淀,过滤、洗涤、干燥即可。请依次写出上述方案涉及的离子方程式、。(7)GaN作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:①仪器X中的试剂是(填名称)。②加热前需先打开A中的活塞一段时间,目的是。③E中生成GaN的化学方程式为。④装置F的作用为。3镓是一种低熔点、高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业。回答下列问题:I.镓(Ga)的原子结构示意图为。(1)镓元素在元素周期表中的位置是。(2)GaAs的熔点为1238°C,且熔融状态不导电,据此判断,该化合物是(填“共价化合物”或“离子化合物”)。(3)已知As与Ga同周期,As与N同主族。①用原子结构理论推测,GaAs中As元素的化合价为。②下列事实不能用元素周期律解释的是(填标序号)。a.原子半径:Ga>Asb.热稳定性:NH3>AsH3c.碱性:Ga(OH)3>Al(OH)3d.酸性:H3AsO4>H3AsO3II.利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4]可制得具有优异光电性能的氮化镓(GaN)。矿渣经“酸浸”后所得酸浸液含有Zn2+、Fe2+、Fe3+、Ga3+等离子。现欲使用萃取的方法,提取其中的镓元素用于后续反应(如图所示)。已知:金属离子在该工艺条件下的萃取率(进入有机层中的金属离子百分数)见下表。金属离子Fe2+Fe3+Zn2+Ga3+萃取率/%099097~98.5(4)写出一种提高“酸浸”反应速率的方法:。(5)“酸浸”过程中Ga2(Fe2O4)3发生反应的离子方程式为。(6)从上表可知,酸浸液直接萃取,效果不好。应先加入某固体X,充分反应,过滤后再进行萃取。固体X最好选用(填化学式)。(7)“反萃取”后,溶液中镓元素的存在形式为(填离子符号)。4GaN凭借其出色的功率性能、频率性能以及散热性能,在光电领域和高频微波器件应用等方面有广阔的前景。(1)Johnson等人首次在1100℃下用镓与氨气制得氮化镓,该可逆反应每生成1molH2放出10.3kJ热量。该反应的热化学方程式是(已知金属镓的熔点是29.8℃,沸点是2403℃;氮化镓的熔点为1700℃)(2)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示(已知图中T1和T2的温度均小于1700℃)。①下列说法正确的是(填标号)。a.相同条件下,GaOH3的碱性比AlOH3强b.当cNH3=cH2时,一定达到了化学平衡状态c.A点和C点化学平衡常数的关系是:KA