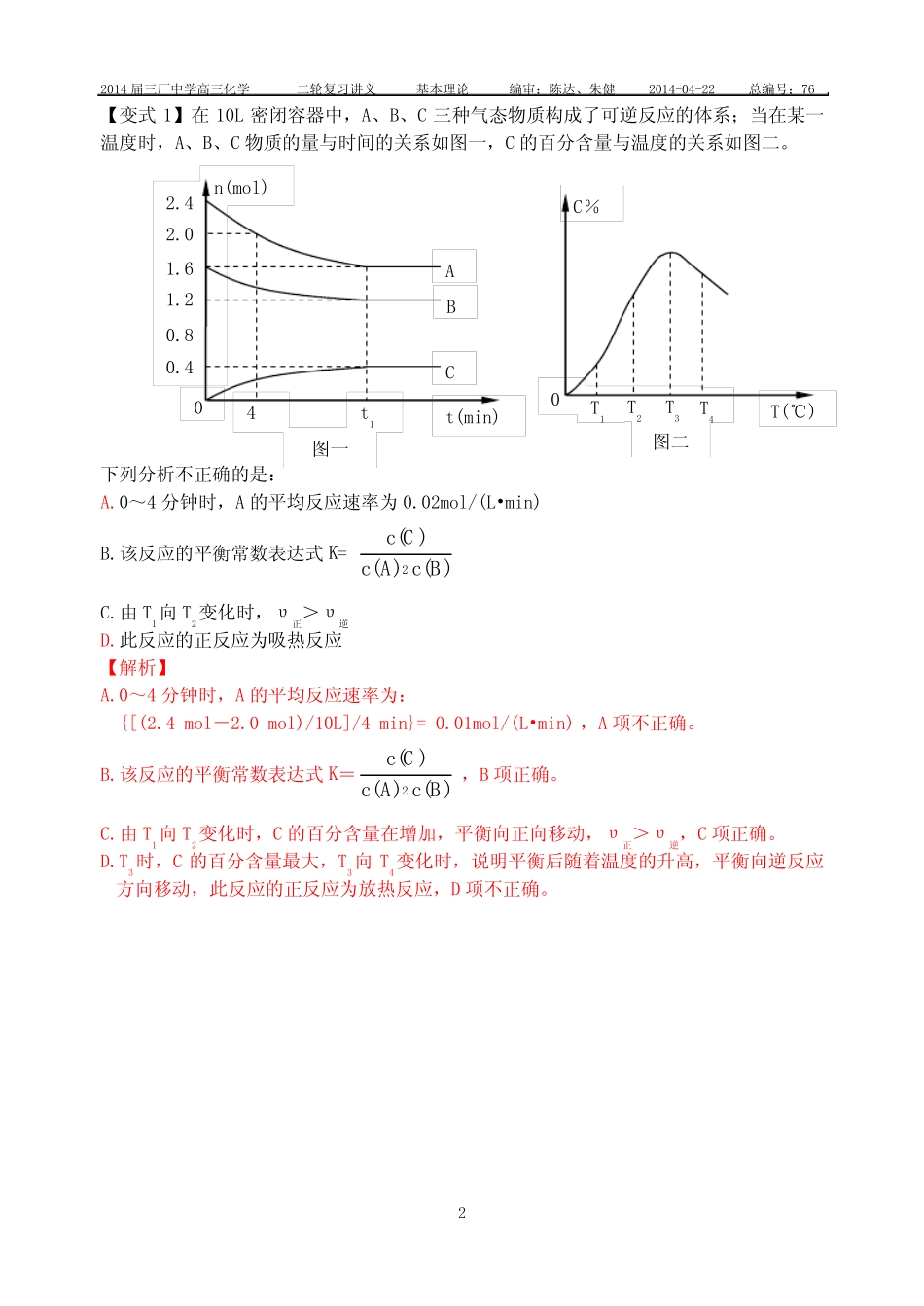
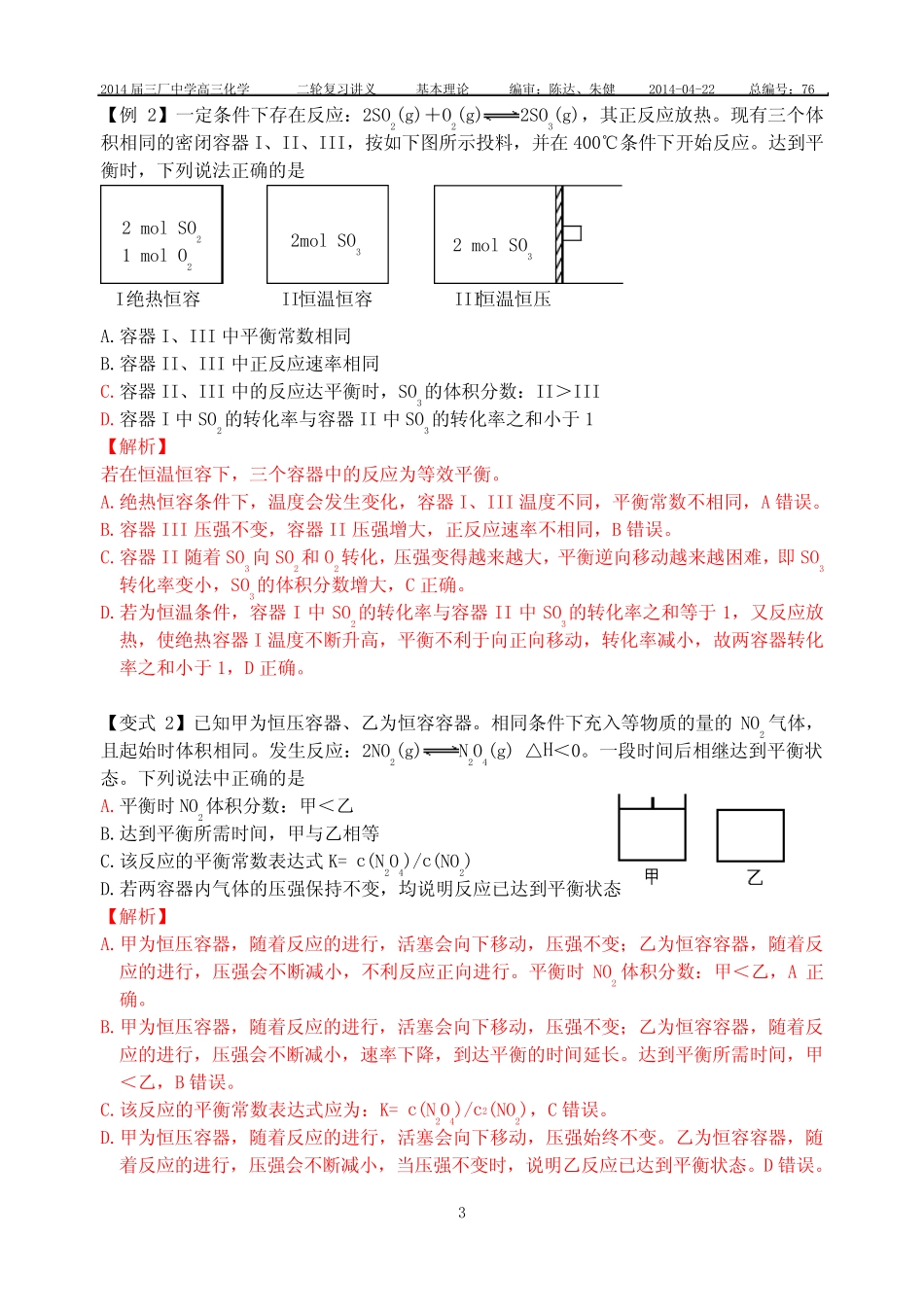
2014届三厂中学高三化学二轮复习讲义基本理论编审:陈达、朱健2014-04-22总编号:761二轮专题十一基础化学平衡的思考方法与建模【课堂目标】1.熟悉基础化学平衡的思考方法。2.学会简单等效平衡的建模方法。3.借本专题着力提高高考试题中第15题中的有效得分率。【基础梳理】【例1】在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是200℃起始时n(A):n(B)平衡时C的体积分数图Ⅱ00.20.40.60.8t/min5图ⅠABCa100℃n/molA.200℃时,反应从开始到平衡的平均速率υ(B)=0.02mol·L-1·min-1B.图Ⅱ所知反应xA(g)+yB(g)zC(g)的△H<0,且a=2C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前υ(正)>υ(逆)D.200℃时,向容器中充入2molA和1molB,达到平衡时,A的体积分数小于0.5【解析】A.200℃时,反应从开始到平衡,B的物质的量的变化为0.2mol,浓度变化为0.1mol·L-1,反应速率υ(B)=0.02mol·L-1·min-1,A项正确。B.a对应的平衡时C的体积分数处于最高点,表明n(A)∶n(B)=2,即a=2,正确,但图Ⅱ可知,温度越高,C的体积分数越大,说明正反应是吸热反应,所以,总体B项错误。C.定温定容条件下,向体系中充入He,各组分浓度不变,反应速率不变,平衡不移动,正逆反应速率相等,C项错误。D.由图I可知,容器中充入0.8molA和0.4molB,平衡时A的体积分数为0.5;若起始时充入2molA和1molB,浓度加倍等效于增大压强,平衡向右移动,A的体积分数小于0.5,D项正确。2014届三厂中学高三化学二轮复习讲义基本理论编审:陈达、朱健2014-04-22总编号:762【变式1】在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。下列分析不正确的是:A.0~4分钟时,A的平均反应速率为0.02mol/(L•min)B.该反应的平衡常数表达式K=)()()(2BcAcCcC.由T1向T2变化时,υ正>υ逆D.此反应的正反应为吸热反应【解析】A.0~4分钟时,A的平均反应速率为:{[(2.4mol-2.0mol)/10L]/4min}=0.01mol/(L•min),A项不正确。B.该反应的平衡常数表达式K=)()()(2BcAcCc,B项正确。C.由T1向T2变化时,C的百分含量在增加,平衡向正向移动,υ正>υ逆,C项正确。D.T3时,C的百分含量最大,T3向T4变化时,说明平衡后随着温度的升高,平衡向逆反应方向移动,此反应的正反应为放热反应,D项不正确。T4T3T2T1T(℃)C%0图二t142.42.01.61.20.80.4t(min)n(mol)CBA0图一2014届三厂中学高三化学二轮复习讲义基本理论编审:陈达、朱健2014-04-22总编号:763【例2】一定条件下存在反应:2SO2(g)+O2(g)2SO3(g),其正反应放热。现有三个体积相同的密闭容器I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是A.容器I、III中平衡常数相同B.容器II、III中正反应速率相同C.容器II、III中的反应达平衡时,SO3的体积分数:II>IIID.容器I中SO2的转化率与容器II中SO3的转化率之和小于1【解析】若在恒温恒容下,三个容器中的反应为等效平衡。A.绝热恒容条件下,温度会发生变化,容器I、III温度不同,平衡常数不相同,A错误。B.容器III压强不变,容器II压强增大,正反应速率不相同,B错误。C.容器II随着SO3向SO2和O2转化,压强变得越来越大,平衡逆向移动越来越困难,即SO3转化率变小,SO3的体积分数增大,C正确。D.若为恒温条件,容器I中SO2的转化率与容器II中SO3的转化率之和等于1,又反应放热,使绝热容器I温度不断升高,平衡不利于向正向移动,转化率减小,故两容器转化率之和小于1,D正确。【变式2】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)N2O4(g)△H<0。一段时间后相继达到平衡状态。下列说法中正确的是A.平衡时NO2体积分数:甲<乙B.达到平衡所需时间,甲与乙相等C.该反应的平衡常数表达式K=c(N2O4)/c(NO2)D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态【解析...