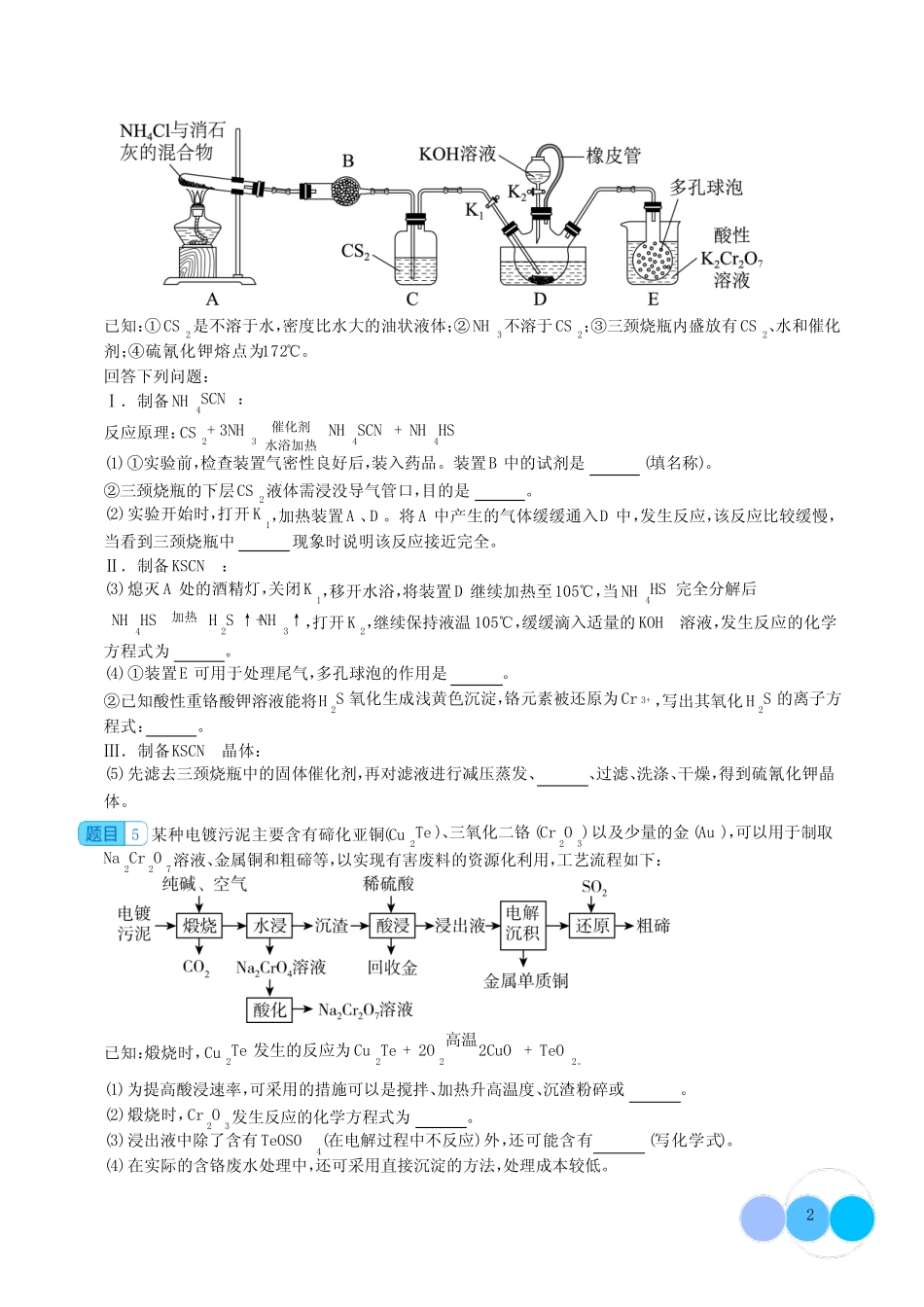
1工业流程题,实验题(铬专题)1某铬贫矿主要成分为Fe(CrO2)2,还含有Fe2O3、MgO、Al2O3,采用次氯酸钠法处理矿石并制备CrO3的工艺流程如图,已知“氧化浸出”时铁以最高价氧化物存在。下列说法错误的是A.“氧化浸出”时煮沸的目的是加快氧化浸出速率B.滤渣的主要成分是MgO、Fe2O3C.化合物I为NaOH,化合物II为NaHCO3D.实验室进行“混合”时,将Na2Cr2O7溶液缓慢倒入浓硫酸中,边倒边搅拌2某铬贫矿主要成分为FeCrO22,还含有Fe2O3、MgO、Al2O3,采用次氯酸钠法处理矿石并制备CrO3的工艺流程如图,已知“氧化浸出”时铁以最高价氧化物存在。下列说法错误的是A.“氧化浸出”时发生的主要反应为:2FeCrO22+7ClO-+2OH-=4CrO2-4+2Fe3++7Cl-+H2OB.滤渣的主要成分是MgO、Fe2O3C.化合物Ⅰ为NaHCO3D.实验室进行“混合”时,将浓硫酸缓慢倒入Na2Cr2O7溶液中,边倒边搅拌3室温时,实验室以含铬废液(主要离子含K+、Fe3+、Cr3+、SO2-4)制取含K2Cr2O7溶液的流程如下:已知:①室温时,KspCrOH3=6×10-31,KspFeOH3=4×10-38②“氧化”时CrOH3转化为CrO2-4下列说法正确的是A.“过滤Ⅰ”所得滤液中cCr3+=6×10-7mol⋅L-1B.“氧化”时的离子方程式为:4OH-+2CrOH3+3H2O2=2CrO2-4+8H2OC.“酸化”时溶液pH越低,CrO2-4转化为Cr2O2-7的比例越低D.将“含K2Cr2O7溶液”蒸干可得纯净的K2Cr2O7固体4硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业上的硫氰化铵转化法制备硫氰化钾的实验装置如图所示:2024届高三化学一轮复习--工业流程题,实验题(铬专题)2已知:①CS2是不溶于水,密度比水大的油状液体;②NH3不溶于CS2;③三颈烧瓶内盛放有CS2、水和催化剂;④硫氰化钾熔点为172℃。回答下列问题:Ⅰ.制备NH4SCN:反应原理:CS2+3NH3催化剂水浴加热NH4SCN+NH4HS(1)①实验前,检查装置气密性良好后,装入药品。装置B中的试剂是(填名称)。②三颈烧瓶的下层CS2液体需浸没导气管口,目的是。(2)实验开始时,打开K1,加热装置A、D。将A中产生的气体缓缓通入D中,发生反应,该反应比较缓慢,当看到三颈烧瓶中现象时说明该反应接近完全。Ⅱ.制备KSCN:(3)熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后NH4HS加热H2S↑+NH3↑,打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为。(4)①装置E可用于处理尾气,多孔球泡的作用是。②已知酸性重铬酸钾溶液能将H2S氧化生成浅黄色沉淀,铬元素被还原为Cr3+,写出其氧化H2S的离子方程式:。Ⅲ.制备KSCN晶体:(5)先滤去三颈烧瓶中的固体催化剂,再对滤液进行减压蒸发、、过滤、洗涤、干燥,得到硫氰化钾晶体。5某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2高温2CuO+TeO2。(1)为提高酸浸速率,可采用的措施可以是搅拌、加热升高温度、沉渣粉碎或。(2)煅烧时,Cr2O3发生反应的化学方程式为。(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有(写化学式)。(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。3①已知含铬酸性废水中存在着CrO2-4和Cr2O2-7相互转化的平衡,请用离子方程式表示它们之间的转化反应。②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为。(写化学式)。(5)测定某固体产品中Na2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O2-7被还原为Cr3+)①氧化还原滴定过程中的离子方程式为。②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中Na2Cr2O7的纯度为%。[已知M(Na2Cr2O7)=262g·mol-1,计算结果保留三位有效数字]③上述实验后所得溶液中除含...