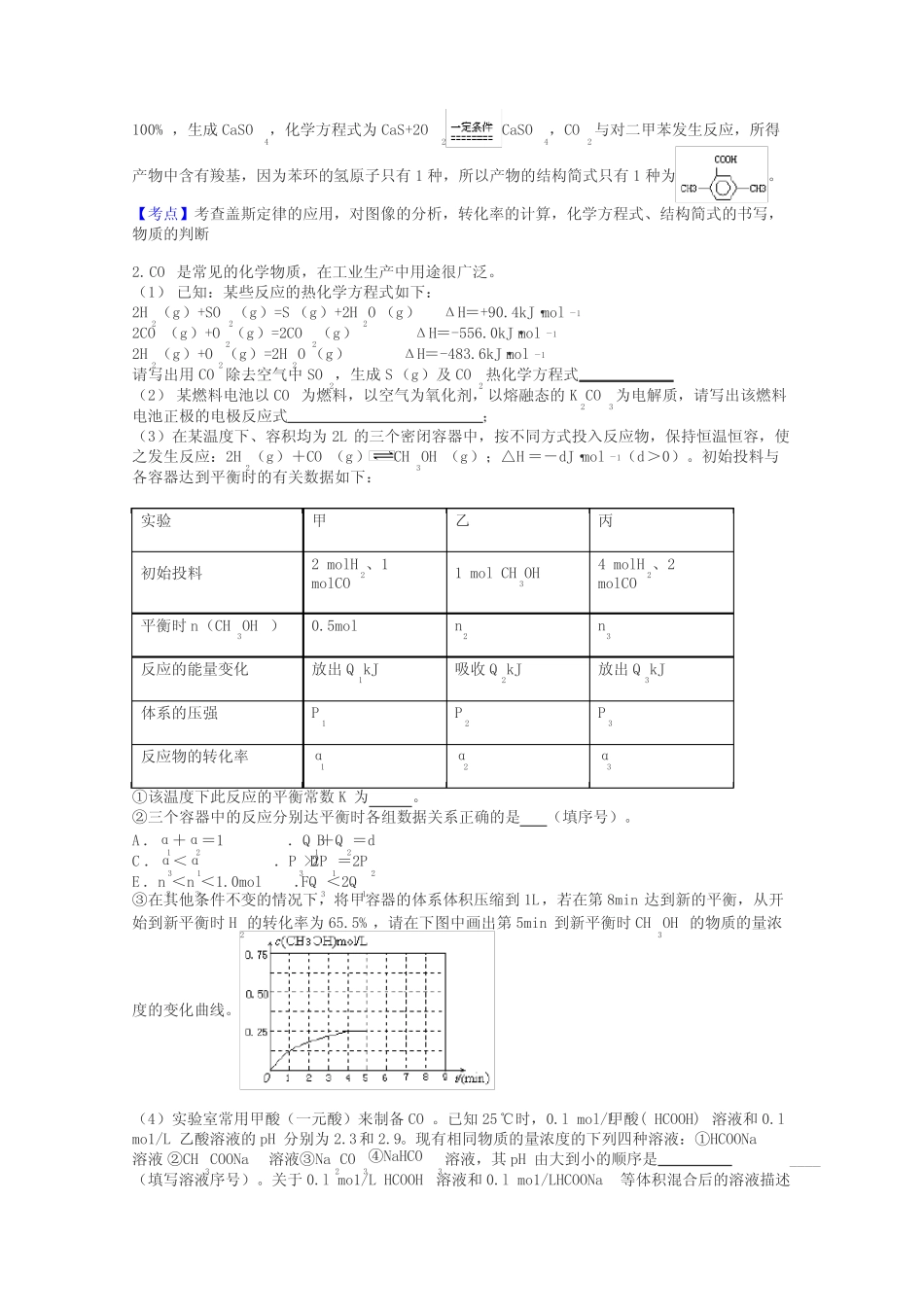
高三化学化学反应热的计算试题答案及解析1.(16分)用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。①1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)△H1=-47.3kJ/mol②CaSO4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ/mol③CO(g)1/2C(s)+1/2CO2(g)△H3=-86.2kJ/mol(1)反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=(用△H1△H2△H3表示)。(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图18.结合各反应的△H,归纳lgK~T曲线变化规律:a)b)(3)向盛有CaSO4的真空恒容容器中充入CO,反应①于900ºC达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留2位有效数字)。(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入。(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生成CaSO4,该反应的化学方程式为;在一定条件下CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为。【答案】(1)4△H1+△H2+2△H3;(2)a)、放热反应的lgK随温度升高而下降;b)、放出或吸收热量越大的反应,其lgK受温度影响越大;(3)99%(4)CO2(5)CaS+2O2CaSO4,【解析】(1)根据盖斯定律可得2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=①×4+②+③×2=4△H1+△H2+2△H3;(2)由图像及反应的△H可知,a)、反应①③是放热反应,随温度升高,lgK降低;反应②是吸热反应,随温度升高,lgK增大;b)、从图像上看出反应②、③的曲线较陡,说明放出或吸收热量越大的反应,其lgK受温度影响越大;(3)由图可知,反应①于900ºC的lgK=2,则K=100,c平衡(CO)=8.0×10-5mol·L-1,平衡时c平衡(CO2)=100×8.0×10-5mol·L-1=8.0×10-3mol·L-1,根据反应1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)可知,消耗CO的浓度是8.0×10-3mol·L-1,则开始时c(CO)=8.0×10-5mol·L-1+8.0×10-3mol·L-1=8.08×10-3mol·L-1,所以CO的转化率为8.0×10-3mol·L-1/8.08×10-3mol·L-1×100%=99%,;(4)根据方程式可知,二氧化碳中含有气体杂质SO2,可在CO中加入适量的CO2,抑制二氧化硫的产生;(5)CaS转化为CaSO4,从元素守恒的角度分析,CaS与氧气发生化合反应,原子的利用率100%,生成CaSO4,化学方程式为CaS+2O2CaSO4,CO2与对二甲苯发生反应,所得产物中含有羧基,因为苯环的氢原子只有1种,所以产物的结构简式只有1种为。【考点】考查盖斯定律的应用,对图像的分析,转化率的计算,化学方程式、结构简式的书写,物质的判断2.CO是常见的化学物质,在工业生产中用途很广泛。(1)已知:某些反应的热化学方程式如下:2H2(g)+SO2(g)=S(g)+2H2O(g)ΔH=+90.4kJ·mol-12CO(g)+O2(g)=2CO2(g)ΔH=-556.0kJ·mol-12H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式(2)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式;(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:实验甲乙丙初始投料2molH2、1molCO1molCH3OH4molH2、2molCO平衡时n(CH3OH)0.5moln2n3反应的能量变化放出Q1kJ吸收Q2kJ放出Q3kJ体系的压强P1P2P3反应物的转化率α1α2α3①该温度下此反应的平衡常数K为。②三个容器中的反应分别达平衡时各组数据关系正确的是(填序号)。A.α1+α2=1B.Q1+Q2=dC.α3<α1D.P3>2P1=2P2E.n2<n3<1.0molF.Q3<2Q1③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min到新平衡时CH3OH的物质的量浓度的变化曲线。(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.lmol/L甲酸(HCOOH)溶液和0.lmo1/L乙酸溶...