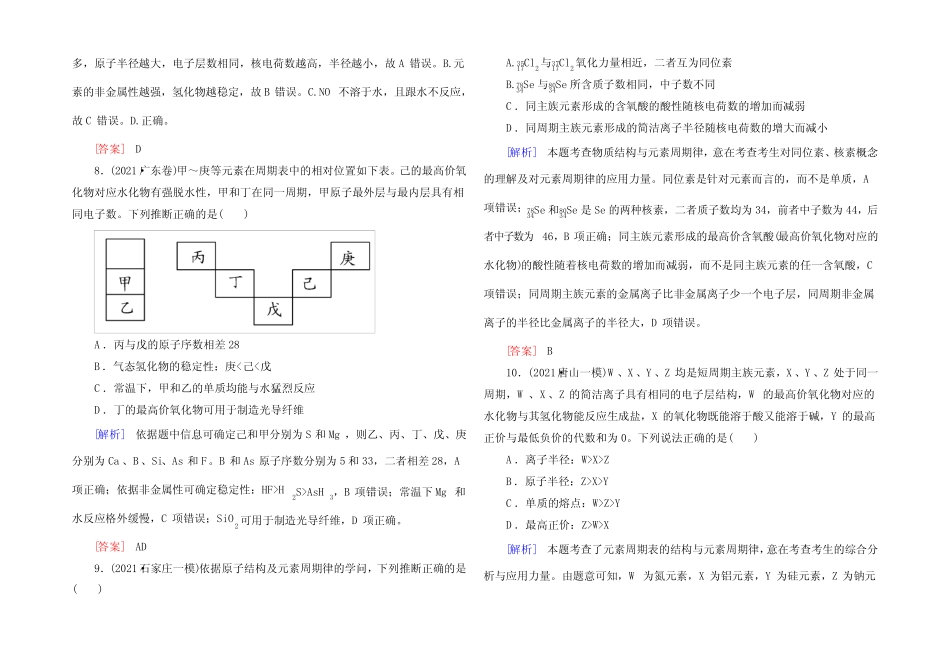
专题跟踪训练(四)一、选择题1.下列关于35Cl和37Cl、O2和O3、1H162O和2H182O的说法正确的是()A.35Cl和37Cl互为同素异形体B.O2和O3是氧元素的两种同位素C.35和37表示的是质量数D.1H162O和2H182O表示同一种水分子[解析]本题考查同位素、同素异形体等,意在考查考生的识记力量。35Cl和37Cl是氯元素的两种核素,互为同位素,A错误。O2和O3是氧元素形成的两种性质不同的单质,互为同素异形体,B错误。1H162O和2H182O不是同种水分子,D错误。[答案]C2.(2021·广东试验中学月考)假设R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为x,则WgRm-所含中子的物质的量为()A.(A-x+m)molB.(A-x-m)molC.WA(A-x+m)molD.WA(A-x-m)mol[解析]依据n(Rm-)=质量摩尔质量≈WAmol,又Rm-的质子数为x-m,则中子数为A-(x-m),所以WgRm-所含中子的物质的量为WA(A-x+m)mol。[答案]C3.(2021·南昌模拟)下表为几种短周期元素的性质:元素编号①②③④⑤⑥⑦⑧原子半径(10-1nm)0.741.601.521.100.991.860.750.82最高或最低化合价-2+2+1+5-3+7-1+1+5-3+3对上述元素有关说法正确的是()A.元素④的原子序数小于元素⑦的原子序数B.②、③处于同一周期C.上述八种元素中,最高价氧化物对应水化物酸性最强的元素是⑤D.⑧号元素原子结构示意图为:[解析]本题考查元素周期表和元素周期律的综合应用,意在考查考生的分析和推断力量。①~⑧都为短周期元素,①有最低价-2,处于ⅥA族,没有最高价,则①为O;④、⑦都有最低价-3、最高价+5,处于ⅤA族,且④的原子半径较大,则④为P、⑦为N;⑤有+7价、-1价,处于ⅦA族,且半径比①大,则⑤为Cl;③、⑥都有+1价,处于ⅠA族,⑥的原子半径较大,且③不是全部元素中原子半径最小的元素,则③为Li、⑥为Na;②有+2价,处于ⅡA族,原子半径大于Li,则②为Mg。⑧有+3价且半径比O大,比P小,则⑧为B。④为P、⑦为N,P的原子序数大于N,故A项错误;②为Mg,③为Li,二者为不同周期的元素,B项错误;⑤为Cl,八种元素中,其非金属性最强,其最高价氧化物对应水化物的酸性最强,C项正确;⑧为B,其原子序数为5,D项错误。[答案]C4.(2021·安徽示范高中联考)工业上常利用液晶显示屏生产过程中产生的废玻璃粉末为原料回收金属铈(Ce),金属铈是一种重要的稀土元素,原子序数为58,它有四种同位素,该元素的相对原子质量为140,下列有关说法正确的是()A.它是第5周期元素B.原子核内肯定有82个中子C.铈的四种同位素形成的中性原子核外电子数相同D.Ce2+中有55个质子[解析]A.Ce是58号元素,位于第六周期,错误。B.铈的四种同位素原子核内中子数都不相同,且依据题目条件无法求得,错误;C.铈的四种同位素形成的中性原子核外电子数等于核内质子数都是58,正确;D.Ce3+离子中有58个质子,错误。[答案]C5.(2021·潍坊一模)下列叙述正确的是()A.同一周期元素的原子,半径越小越简洁失去电子B.元素周期表中全部元素都是从自然界中发觉的,过渡元素都是金属元素C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构D.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物[解析]A.同周期元素从左到右原子半径渐渐减小,非金属性渐渐增加,金属性渐渐减弱。B.很多放射性元素在自然界不存在,多由核反应生成。C.非金属元素形成的共价化合物中,原子的最外层不肯定达到8电子稳定结构。D.ⅠA族与ⅦA族元素间形成的化合物中氢化物为共价化合物,其他为离子化合物。[答案]D6.(2021·西安一模)下列各组物质的性质比较不正确的是()A.热稳定性:SiH4>PH3>H2SB.酸性:HClO4>H2SO4>H3PO4C.碱性:NaOH>Mg(OH)2>Al(OH)3D.氧化性:F2>Cl2>Br2[解析]A.非金属性:Si
Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物酸性越强,故C正确。D.非金属性:F>Br>I,元素的非金属性越强,对应的单质氧化性越强,故D正确。[答案]A7.(202...