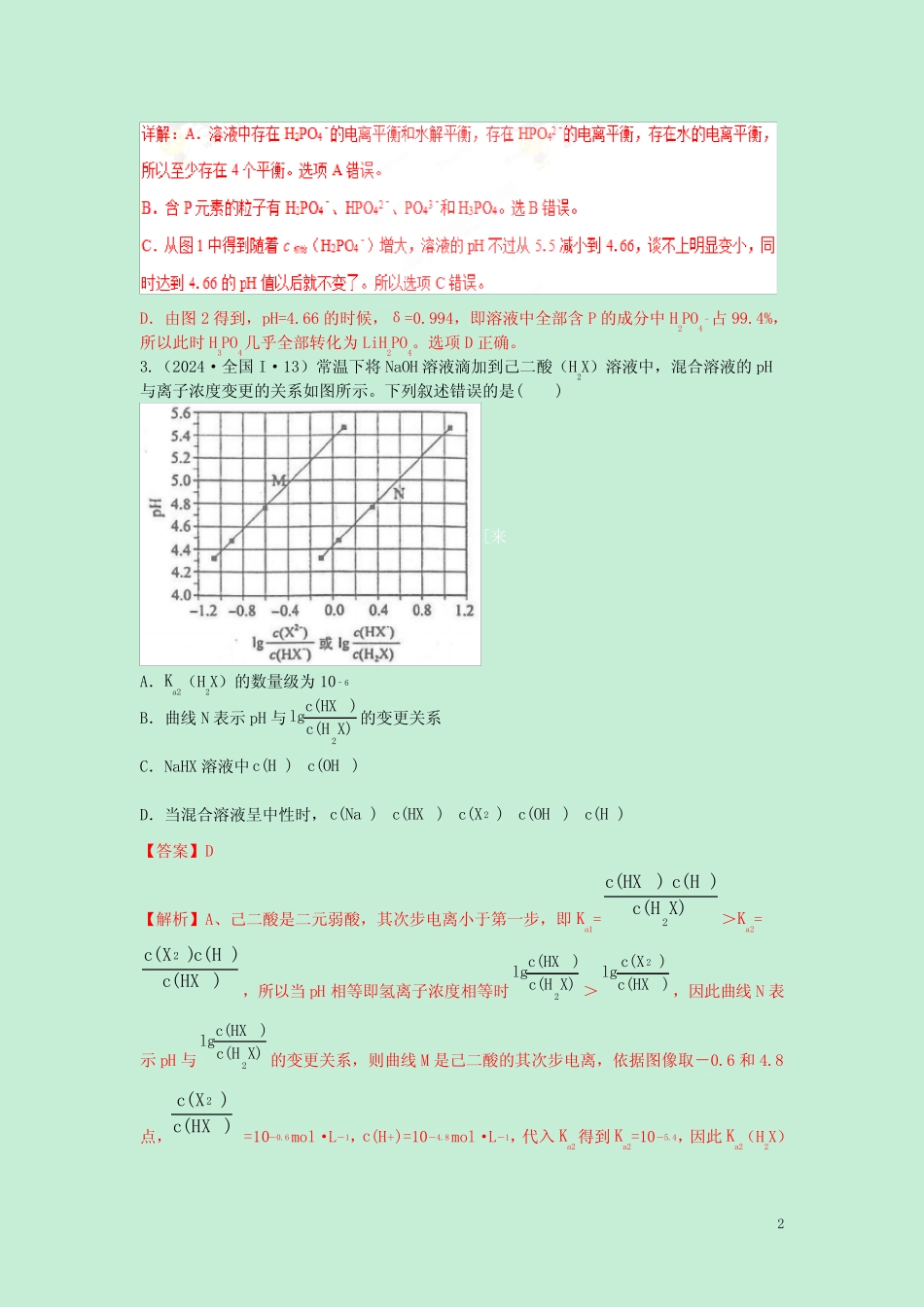
1专题13盐类的水解及沉淀的溶解平衡1.(2024·浙江4月选考·24)聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确的是A.KClO3作氧化剂,每生成1mol[Fe(OH)SO4]n消耗6/nmolKClO3B.生成聚合硫酸铁后,水溶液的pH增大C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水D.在相同条件下,Fe3+比[Fe(OH)]2+的水解实力更强【答案】A【解析】本题以聚合硫酸铁的制备和性质为背景考查氧化还原反应,盐类水解的原理、应用以及胶体的性质。FeSO4和KClO3反应生成\[Fe(OH)SO4\]n的化学方程式为6nFeSO4+nKClO3+3nH2O6\[Fe(OH)SO4\]n+nKCl,依据化学方程式可知,KClO3作氧化剂,每生成1mol\[Fe(OH)SO4\]n消耗n/6molKClO3,A项错误;[Fe(OH)]2+的水解实力小于Fe2+,导致生成聚合硫酸铁后,溶液碱性增加,B项正确;\[Fe(OH)\]2+可在水中水解生成Fe(OH)3胶体而净水,C项正确;比较Fe3+和\[Fe(OH)\]2+的水解实力,可以从二者所带电荷的多少来分析,所带正电荷越多,结合OH-的实力就越强,水解实力就越强,D项正确,故选A。【技高一筹】利用氧化还原反应中得失电子守恒,可以快速求算消耗KClO3的物质的量:每生成1mol[Fe(OH)SO4]n转移的电子为nmol,而1molKClO3参加反应时转移的电子为6mol,故每生成1mol[Fe(OH)SO4]n消耗KClO3的物质的量为n/6mol,A项错误。2.(2024·天津·6)LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变更如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变更如图2所示,[]下列有关LiH2PO4溶液的叙述正确的是()A.溶液中存在3个平衡B.含P元素的粒子有H2PO4–、HPO42–、PO43–C.随c初始(H2PO4–)增大,溶液的pH明显变小D.用浓度大于1mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4【答案】D【解析】本题考查电解质溶液的相关学问。应当从题目的两个图入手,结合磷酸的基本性质进行分析。2D.由图2得到,pH=4.66的时候,δ=0.994,即溶液中全部含P的成分中H2PO4–占99.4%,所以此时H3PO4几乎全部转化为LiH2PO4。选项D正确。3.(2024·全国I·13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变更的关系如图所示。下列叙述错误的是()[来A.Ka2(H2X)的数量级为10–6B.曲线N表示pH与2(HX)lg(HX)cc的变更关系C.NaHX溶液中(H)(OH)ccD.当混合溶液呈中性时,2(Na)(HX)(X)(OH)(H)ccccc【答案】D【解析】A、己二酸是二元弱酸,其次步电离小于第一步,即Ka1=2(HX)(H)(HX)ccc>Ka2=2(X)(H)(HX)ccc,所以当pH相等即氢离子浓度相等时2(HX)lg(HX)cc>2(X)lg(HX)cc,因此曲线N表示pH与2(HX)lg(HX)cc的变更关系,则曲线M是己二酸的其次步电离,依据图像取-0.6和4.8点,2(X)(HX)cc=10-0.6mol·L-1,c(H+)=10-4.8mol·L-1,代入Ka2得到Ka2=10-5.4,因此Ka2(H2X)3的数量级为10–6,A正确;B.依据以上分析可知曲线N表示pH与2(HX)lg(HX)cc的关系,B正确;C.曲线N是己二酸的第一步电离,依据图像取0.6和5.0点,2(HX)(HX)cc=100.6mol·L-1,c(H+)=10-5.0mol·L-1,代入Ka1得到Ka1=10-4.4,因此HX-的水解常数是w1aKK=10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH-),C正确;D.依据图像可知当2(X)lg(HX)cc=0时溶液显酸性,因此当混合溶液呈中性时,2(X)lg(HX)cc>0,即c(X2–)>c(HX–),D错误;答案选D。4.(2024·北京·11)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电实力随滴入溶液体积变更的曲线如图所示。下列分析不正确...的是()A.①代表滴加H2SO4溶液的变更曲线B.b点,溶液中大量存在的离子是Na+、OH–C.c点,两溶液中含有相同量的OH–D.a、d两点对应的溶液均显中性【答案】C【解析】45.(2024·江苏·7)下列说法正确的是()A.氢氧燃料电池工作时,H2在负极上失去电子B.0.1mol/LNa2CO3溶液加热后,溶液的pH减小C.常温常压下,22.4LCl2中含有的分子数为6.02×1023个D.室温下,稀释0.1mo...