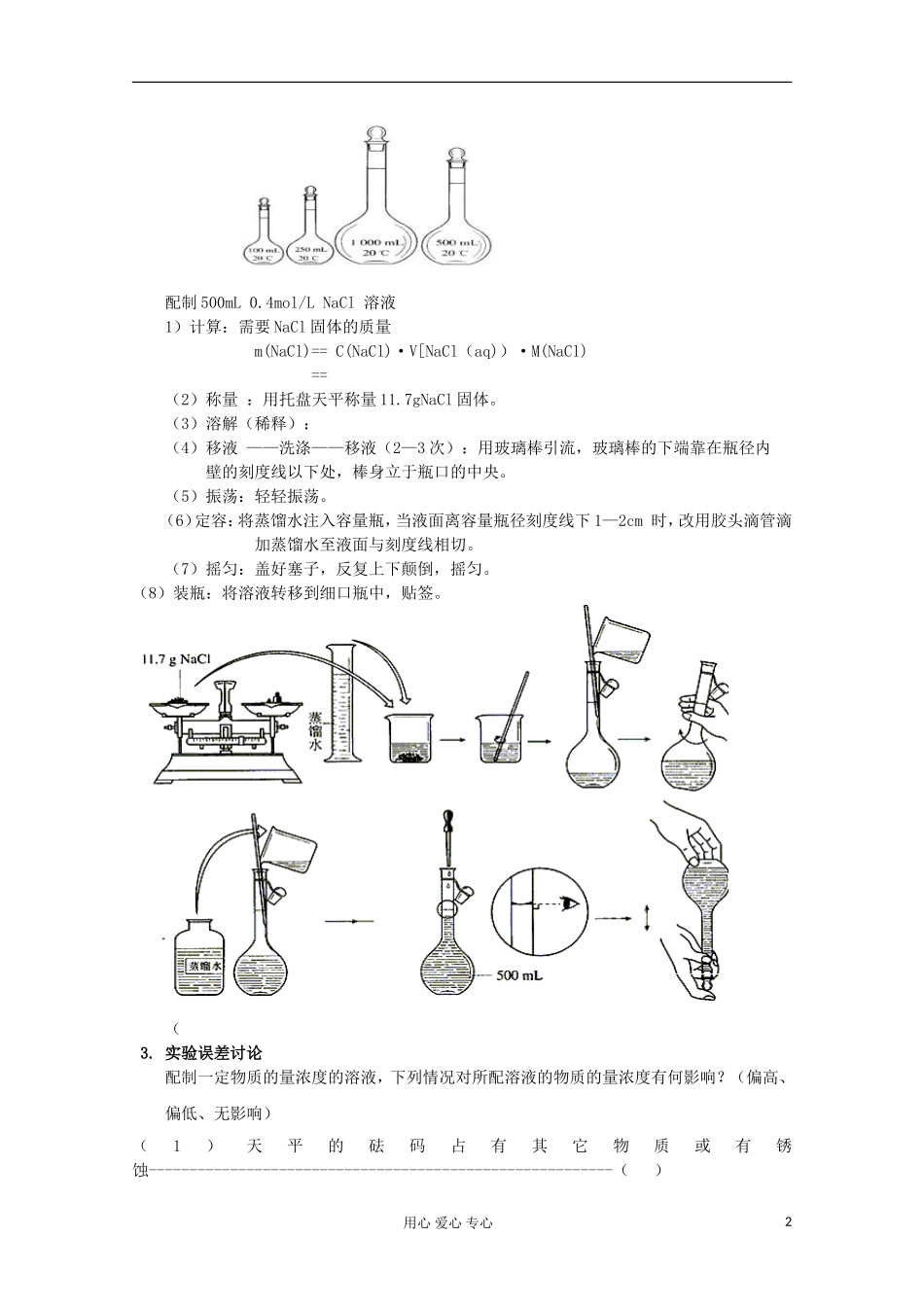
第二节化学计量在实验中的应用第三课时——物质的量在化学实验中的应用教学目标知识与技能①理解物质的量浓度的概念,掌握与物质的量浓度有关的计算、分析方法;②通过活动探究,使学生掌握一定物质的量浓度溶液配制的基本要领和技巧;③通过交流讨论,让学生从物质的量的角度认识化学反应。过程与方法通过配制一定物质的量浓度的溶液,体验以实验为基础的实例研究方法,能独立地与同学合作完成实验,记录实验现象和数据,并对实验结果进行研究讨论。情感态度与价值观①通过亲自实验配制溶液,体验化学实验的严谨性,培养端正耐心的学习态度和实事求是的科学精神;②通过对实验结果的分析讨论,培养学生尊重科学、求真务实的科学态度;教学重点与难点:①物质的量浓度的概念及有关计算;②一定物质的量浓度的溶液的配制方法。复习:1.气体摩尔体积与物质的量的换算公式2.阿伏加德罗定律的内容是什么?3.阿伏加德罗定律应用举例新课:一、物质的量浓度1.定义:以里所含的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。2.符号:CB3.单位:mol/L(或mol·L-1)4.表达式:CB===————[例1]配制500mL0.1mol/L的Na2CO3溶液,需要Na2CO3的质量是多少?解:二、一定物质的量浓度溶液的配制1.需用仪器:天平(带砝码)、药匙、容量瓶、量筒、烧杯、玻璃棒、胶头滴管“容量瓶简介:(1)规格:配制一定物质的量浓度的溶液,要使用一种容积精确的仪器—容量瓶。容量瓶有各种不同规格,常用的有100mL、250mL、500mL、和1000mL等几种。(2)标记:容量瓶上有三项标记:①容量②使用温度③环形刻度线(3)使用:①使用前要检查塞子是否漏水:往容量瓶里加入一定量的水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,将瓶倒置半分钟左右,如不漏水,将瓶正立,并将瓶塞旋转1800后再倒置,若不漏水,才能使用。①使用温度要与容量瓶上标有的温度一致,不能加入过热、过冷液体。②③不能在容量瓶中溶解或稀释浓溶液,不能贮存液体。用心爱心专心1nBV配制500mL0.4mol/LNaCl溶液1)计算:需要NaCl固体的质量m(NaCl)==C(NaCl)·V[NaCl(aq))·M(NaCl)==(2)称量:用托盘天平称量11.7gNaCl固体。(3)溶解(稀释):(4)移液——洗涤——移液(2—3次):用玻璃棒引流,玻璃棒的下端靠在瓶径内壁的刻度线以下处,棒身立于瓶口的中央。(5)振荡:轻轻振荡。(6)定容:将蒸馏水注入容量瓶,当液面离容量瓶径刻度线下1—2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切。(7)摇匀:盖好塞子,反复上下颠倒,摇匀。(8)装瓶:将溶液转移到细口瓶中,贴签。(3.实验误差讨论配制一定物质的量浓度的溶液,下列情况对所配溶液的物质的量浓度有何影响?(偏高、偏低、无影响)(1)天平的砝码占有其它物质或有锈蚀---------------------------------------------------------()用心爱心专心2(2)试剂、砝码的左右位置颠倒(未用游码)----------------------------------------------()(3)转移溶液时不洗涤烧杯、玻璃棒,或洗涤液未转移到容量瓶中-------------()(4)砝码有残缺--------------------------------------------------------------------------------------()(5)在敞口的容器中称量易吸收空气中其它成分或易于挥发的物质时动作过慢----()(6)所用溶质含有其它杂质----------------------------------------------------------------------()(7)调整天平零点时,游码放在了刻度线的右端。称量时使用了游码-----------------()(8)用量筒量取液体时,仰视读数-------------------------------------------------------------()(9)称量含结晶水的溶质时,溶质已风化----------------------------------------------------()(10)定容时俯视刻度线---------------------------------------------------------------------------()(11)溶解、转移、洗涤时有液体流出至容器外---------------------------------------------()(12)定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线---------------------()(13)定容时加水过...