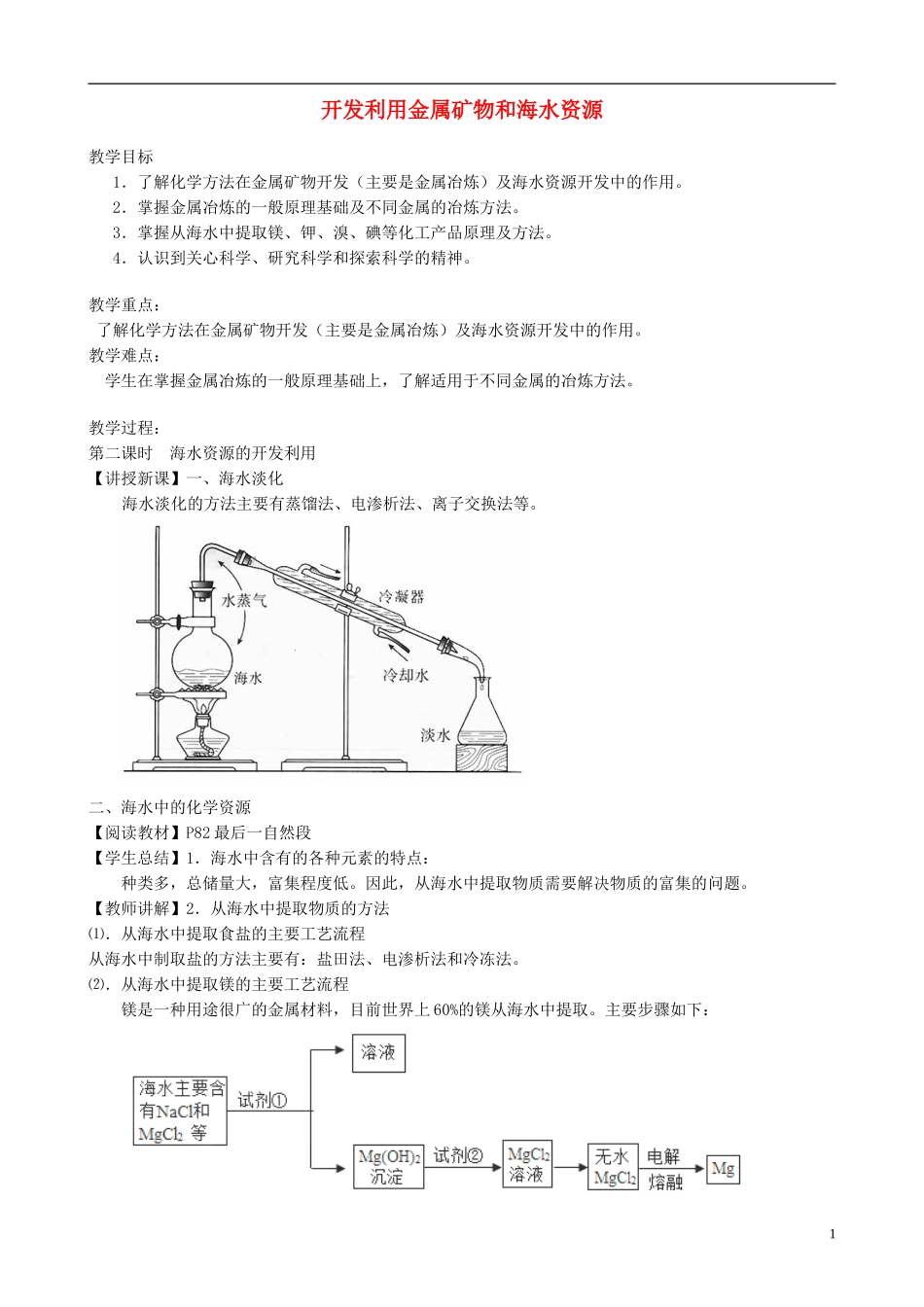
开发利用金属矿物和海水资源教学目标1.了解化学方法在金属矿物开发(主要是金属冶炼)及海水资源开发中的作用。2.掌握金属冶炼的一般原理基础及不同金属的冶炼方法。3.掌握从海水中提取镁、钾、溴、碘等化工产品原理及方法。4.认识到关心科学、研究科学和探索科学的精神。教学重点:了解化学方法在金属矿物开发(主要是金属冶炼)及海水资源开发中的作用。教学难点:学生在掌握金属冶炼的一般原理基础上,了解适用于不同金属的冶炼方法。教学过程:第二课时海水资源的开发利用【讲授新课】一、海水淡化海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。二、海水中的化学资源【阅读教材】P82最后一自然段【学生总结】1.海水中含有的各种元素的特点:种类多,总储量大,富集程度低。因此,从海水中提取物质需要解决物质的富集的问题。【教师讲解】2.从海水中提取物质的方法⑴.从海水中提取食盐的主要工艺流程从海水中制取盐的方法主要有:盐田法、电渗析法和冷冻法。⑵.从海水中提取镁的主要工艺流程镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如下:1(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用,要使MgCl2完全转化为沉淀,加入试剂①的量应,验证MgCl2已完全转化为Mg(OH)2的方法是。(2)加入试剂①,能够分离得到Mg(OH)2沉淀的方法是。(3)试剂②可以选用。(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式。答案.(1)过量NaOH取上层清液,滴入NaOH溶液,不产生沉淀(2)过滤(3)HCl(4)MgCl2Mg+Cl2↑⑶.从海水中提取溴的主要工艺流程【科学探究】P83设计一个实验方案模拟从海水中提取溴,并写出反应的方程式。①用蒸馏法将海水浓缩。用硫酸将浓缩的海水酸化。②向酸化的海水中通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl2=Br2+2NaCl③向含溴单质的水溶液中通入空气和水蒸汽,将溴单质吹入盛有二氧化硫溶液的吸收塔内以达到富集的目的:Br2+SO2+2H2O=2HBr+H2SO4④向吸收塔内的溶液中通入适量的氯气:2HBr+Cl2=2HCl+Br2⑤用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。【科学探究】怎样通过实验证明海带中确实存在碘元素。⑷.从海带中提取碘的实验【演示实验】课本P83实验4-2①反应原理:海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。用H2O2做氧化剂,反应的离子方程式是:2I-+H2O2+2H+=I2+2H2O②提取流程③实验注意事项海带不要用水洗,以免洗去海带中的碘;用干海带从而易于燃烧;灼烧海带的地方要注意通风。3.海水综合利用联合工业体系一例(如教材P84图)(投影展示)三、海水资源的开发利用简述(1)从海水中提取淡水——海水淡化(2)海水制盐(3)从海水中提取镁、钾、溴、碘等化工产品(4)从海水中获取铀和重水作为核能开发的重要原料(5)从海水中获取其他物质和能量[课堂练习1]海水的综合利用可以制备金属镁,其流程如下图所示:含碘单质的有机溶液含碘单质的溶液试剂残渣含碘元素的溶液灼烧海带溶解,过滤海带灰2写出制取金属镁的相关离子方程式。3