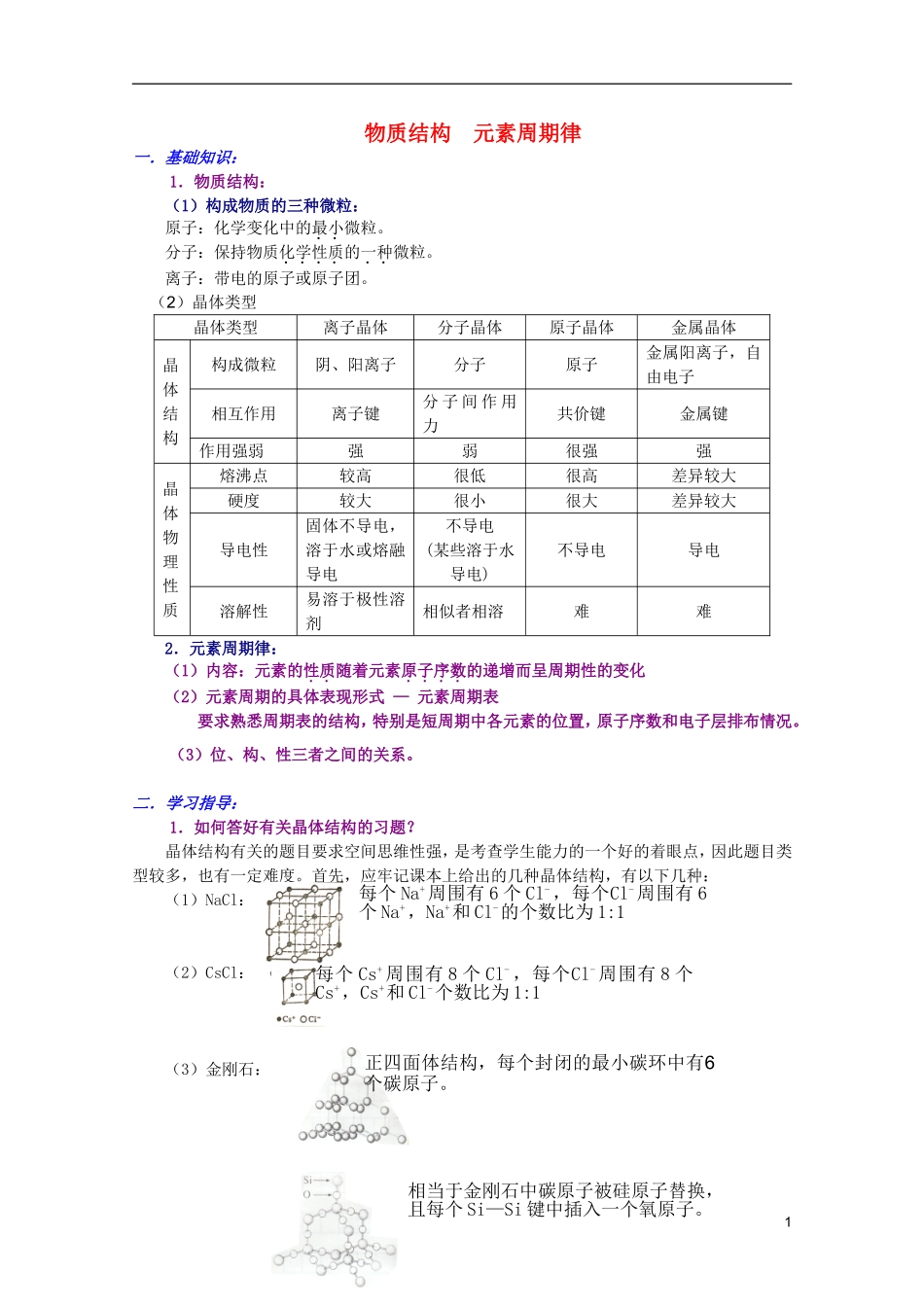
物质结构元素周期律一.基础知识:1.物质结构:(1)构成物质的三种微粒:原子:化学变化中的最小微粒。分子:保持物质化学性质的一种微粒。离子:带电的原子或原子团。(2)晶体类型晶体类型离子晶体分子晶体原子晶体金属晶体晶体结构构成微粒阴、阳离子分子原子金属阳离子,自由电子相互作用离子键分子间作用力共价键金属键作用强弱强弱很强强晶体物理性质熔沸点较高很低很高差异较大硬度较大很小很大差异较大导电性固体不导电,溶于水或熔融导电不导电(某些溶于水导电)不导电导电溶解性易溶于极性溶剂相似者相溶难难2.元素周期律:(1)内容:元素的性质随着元素原子序数的递增而呈周期性的变化(2)元素周期的具体表现形式—元素周期表要求熟悉周期表的结构,特别是短周期中各元素的位置,原子序数和电子层排布情况。(3)位、构、性三者之间的关系。二.学习指导:1.如何答好有关晶体结构的习题?晶体结构有关的题目要求空间思维性强,是考查学生能力的一个好的着眼点,因此题目类型较多,也有一定难度。首先,应牢记课本上给出的几种晶体结构,有以下几种:(1)NaCl:(2)CsCl:(3)金刚石:1每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,Na+和Cl-的个数比为1:1每个Cs+周围有8个Cl-,每个Cl-周围有8个Cs+,Cs+和Cl-个数比为1:1正四面体结构,每个封闭的最小碳环中有6个碳原子。相当于金刚石中碳原子被硅原子替换,且每个Si—Si键中插入一个氧原子。(4)SiO2:(5)石墨:(6)CO2晶体:另外,由这些基础结构中演变出来的一些结论,也要记牢,有以下几种:(1)在NaCl晶体中,每个Na+的周围与最接近的且距离相等的Na+共有12个。(2)在CsCl晶体中,每个Cs+的周围与它最接近的且距离相等的Cs+共有6个。(3)在CO2晶体中,每个CO2分子的周围与它最近且距离相等的CO2分子共有12个。(4)每mol金刚石中含有2molC—C共价键。(5)每mol石墨中含有1.5molC—C共价键。(6)每molP4中含有6molP—P共价键。(7)具有正四面体结构的几种物质:①实心正四面体,即键角109°28’。原子晶体:金刚石,晶体硅;分子晶体:CH4,CCl4等;离子:NH4+,SO42-②空心正四面体,即键角60°。分子晶体:白磷P4。最后,遇到未知晶体,确定晶体中原子(离子)的个数比的方法是:将每种粒子在该单元中的个数与被n个单元共有数之比,将n种粒子的该值再比,即为该晶体中原子(离子)的个数比。具体例题见例题精析例1。2.元素周期表反应了哪些规律?同周期(左→右)同主族(上→下)原子核电荷数逐渐增大增大电子层数相同;电子层数=周期数增多2每层平面正六边形,平均每个正六边形占有的碳原子数为2个。正立方体的顶点,面心各有一个CO2分子。结构最外层子数逐渐增多(1~8)相同;最外层电子数=主族序数原子半径逐渐减小(稀有气体除外)增大化合价最高正价+1→+7;负价:-4→-1最高正价,负价相等;最高正价=主族序数元素的金属性和非金属性金属性减弱,非金属性增强金属性增强,非金属性减弱单质的氧化性,还原性还原性减弱,氧化性增强还原性增强,氧化性减弱最高价氧化物水化物的酸碱性碱性减弱,酸性增强碱性增强,酸性减弱非金属气态氢化物稳定性增强减弱水溶液的酸性增强增强单质熔沸点金属单质升高非金属单质降低(稀有气体熔沸点最低)金属单质降低(ⅣA,Sn例外)非金属单质升高3.如何判断微粒半径的大小?(1)对同种元素来说:阳离子半径小于其原子半径;阴离子半径大于其原子半径;高价阳离子半径小于其低价阳离子半径,如Fe3+