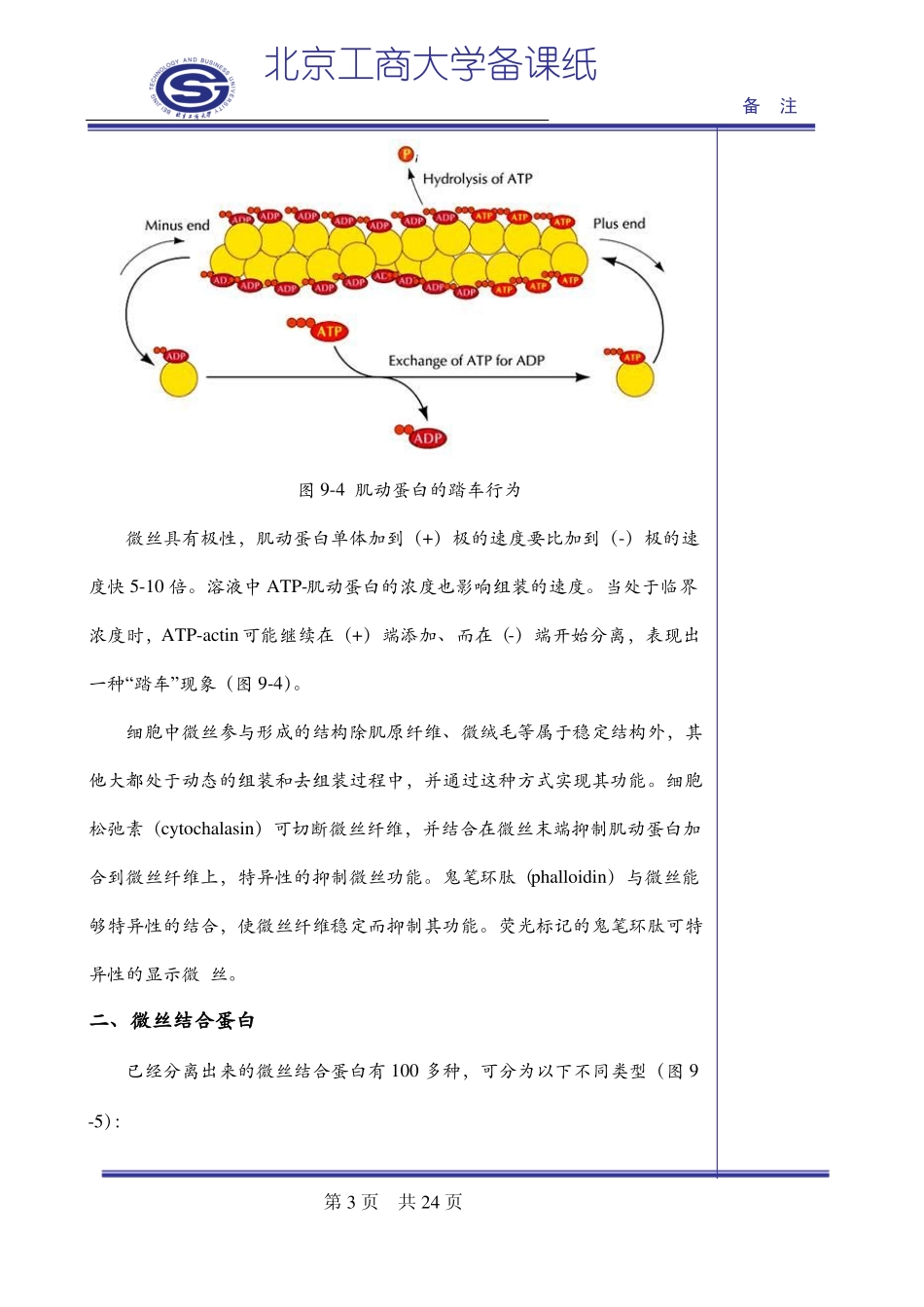
北京工商大学备课纸备注第九章细胞骨架第一节微丝微丝(microfilament,MF)是由肌动蛋白(actin)组成的直径约7nm的骨架纤维,又称肌动蛋白纤维actinfilament。微丝和它的结合蛋白(associationprotion)以及肌球蛋白(myosin)三者构成化学机械系统,利用化学能产生机械运动。一、分子结构根据等电点的不同可将高等动物细胞内的肌动蛋白分为3类,α分布于各种肌肉细胞中,β和γ分布于肌细胞和非肌细胞中。肌动蛋白纤维是由两条线性排列的肌动蛋白链形成的螺旋,状如双线捻成的绳子(图9-2、3),肌动蛋白的单体为球形分子,称为球形肌动蛋白G-actin(globularactin),它的多聚体称为纤维形肌动蛋白F-actin(fibrousactin)。图9-2微丝纤维的负染电镜照片第1页共24页北京工商大学备课纸备注图9-3微丝纤维结构模型肌动蛋白在进化上高度保守,酵母和兔子肌肉的肌动蛋白有88%的同源性。不同类型肌肉细胞的α-肌动蛋白分子一级结构(约400个氨基酸残基)仅相差4~6个氨基酸残基,β-肌动蛋白或γ-肌动蛋白与α-横纹肌肌动蛋白相差约25个氨基酸残基。多数简单的真核生物,如酵母或粘菌,含单个肌动蛋白基因,仅合成一种肌动蛋白。真核生物含有多个肌动蛋白基因,如海胆有11个,网柄菌属(Dictyostelium)有17个,在某些植物中有60个。肌动蛋白要经过翻译后修饰,如N-端乙酰化或组氨酸残基的甲基化。在适宜的温度,存在ATP、K+、Mg2+离子的条件下,肌动蛋白单体可自组装为纤维。ATP-actin(结合ATP的肌动蛋白)对微丝纤维末端的亲和力高,ADP-actin对纤维末端的亲和力低,容易脱落。当溶液中ATP-actin浓度高时,微丝快速生长,在微丝纤维的两端形成ATP-actin“帽子”,这样的微丝有较高的稳定性。伴随着ATP水解,微丝结合的ATP就变成了ADP,当ADP-actin暴露出来后,微丝就开始去组装而变短。第2页共24页北京工商大学备课纸备注图9-4肌动蛋白的踏车行为微丝具有极性,肌动蛋白单体加到(+)极的速度要比加到(-)极的速度快5-10倍。溶液中ATP-肌动蛋白的浓度也影响组装的速度。当处于临界浓度时,ATP-actin可能继续在(+)端添加、而在(-)端开始分离,表现出一种“踏车”现象(图9-4)。细胞中微丝参与形成的结构除肌原纤维、微绒毛等属于稳定结构外,其他大都处于动态的组装和去组装过程中,并通过这种方式实现其功能。细胞松弛素(cytochalasin)可切断微丝纤维,并结合在微丝末端抑制肌动蛋白加合到微丝纤维上,特异性的抑制微丝功能。鬼笔环肽(phalloidin)与微丝能够特异性的结合,使微丝纤维稳定而抑制其功能。荧光标记的鬼笔环肽可特异性的显示微丝。二、微丝结合蛋白已经分离出来的微丝结合蛋白有100多种,可分为以下不同类型(图9-5):第3页共24页北京工商大学备课纸备注1.核化蛋白(nucleatingprotein)核化(nucleation)是纤维组装的第一步,即几个蛋白单体先组装成多聚体,然后其它单体继续添加形成长纤维分子。Arp(actin-relatedprotein)复合体在体内和体外都可以促进肌动蛋白的核化,其作用就像一个模板,类似于微管组织中心的γ球蛋白复合体,Arp复合体由Arp2、Arp3和5种其它蛋白构成。Arp与actin在结构上具有同源性。2.单体隐蔽蛋白(monomersequesteringprotein)细胞中约有50%的肌动蛋白为可溶性肌动蛋白,大大高于肌动蛋白组装所需的临界浓度。但是这些蛋白与其它蛋白结合,构成一个隐蔽的蛋白库。只有当细胞需要组装纤维的时候这些可溶性肌动蛋白才被释放出来。如:thymosin与actin结合可阻止其向纤维添加,抑制其水解或交换结合的核苷酸。隔离蛋白3.封端蛋白(end-blockingprotein)作用是调节肌动蛋白纤维的长度,结合在(+)或(-)极形成“帽子”,阻止其它单体添加。如骨骼肌细肌丝的(-)端被tropomodulin封闭,(+)端被CapZ封闭。4.单体聚合蛋白(monomerpolymerizingprotein)如profilin结合在actin的ATP结合位点相对的一侧,能与thymosin竞争结合actin,profilin可将结合的单体安装到纤维的(+)极。5.微丝解聚蛋白(actin-filamentdepolymerizingprotein)如cofilin可结合在纤维的(-)极,使微丝去组装。这种蛋白在微管快第4页共24页北京工商大学备...