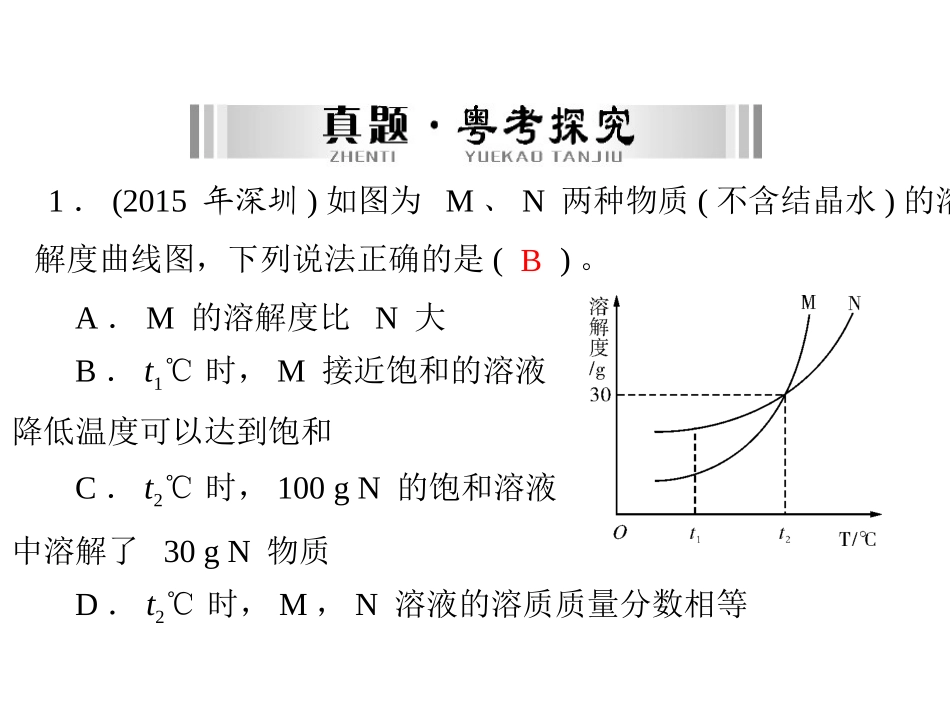
第5讲溶液近三年广东中考考点分布及分值2013年2014年2015年难易度1.溶解现象(理解)2.水是重要的溶剂,酒精、汽油也是常见的溶剂(了解)选择2分容易3.饱和溶液和溶解度的含义(了解)填空1分选择2分填空3分中等4.结晶现象(了解)填空1分填空2分填空1分容易5.能进行溶质质量分数的简单计算(应用)填空2分填空1分计算5分选择2分中等6.学会配制一定溶质质量分数的溶液(操作)1.(2015年深圳)如图为M、N两种物质(不含结晶水)的溶解度曲线图,下列说法正确的是()。BA.M的溶解度比N大B.t1℃时,M接近饱和的溶液降低温度可以达到饱和C.t2℃时,100gN的饱和溶液中溶解了30gN物质D.t2℃时,M,N溶液的溶质质量分数相等温度/℃1020304050KCl溶液度/g30g33g35g38g41gKNO3溶液度/g21g31g45g65g88g2.(2014年广东)KCl与KNO3在不同温度的溶解度数据如下表。则下列说法正确的是()。BA.KNO3比KCl的溶解度大B.两物质的溶解度相等的温度在20℃~30℃之间C.在20℃时,10g水中加入5gKCl可得到33.3%的KCl溶液D.在50℃时,两物质各5g分别加入10g水中,充分溶解,均有固体剩余3.(2015年广东)下表为氯化钠和氯化铵在不同温度时的溶解度,回答下列问题:(1)由表中数据可知,溶解度随温度变化较大的物质是____________。NH4Cl36.010~20(2)20℃时100g水最多只能溶解NaCl______g,氯化钠与氯化铵溶解度相等的温度在______℃之间。13.2(3)向烧杯中加入100g水和50.0g氯化铵配成50℃的溶液,再冷却到20℃,烧杯中析出固体为______g。温度/℃01020304050NH4Cl溶解度/g29.433.337.241.445.850.4NaCl溶解度/g35.735.836.036.336.637.04.(2013年广东)右图是A、B两种物质的溶解度曲线,根据图示回答下列问题:<>(1)t1℃时,A、B两种物质的溶解度是A________B(填“>”“<”或“=”,下同)。(2)将t3℃的A、B两种物质的饱和溶液各200g降温至t1℃,析出晶体的质量关系是:A________B。(3)t2℃时,100g水中溶解50gA刚好饱和,那么50g水中溶解________gB也刚好饱和,此时溶液中溶质的质量分数是________(精确到0.1%)。2533.3%考点一溶液1.溶液的概念溶液是一种或几种物质________到另一种物质里,形成均一、稳定的混合物。分散相等2.溶液的特征(1)均一性:溶液各部分组成、浓度、密度都________。(2)稳定性:外界条件不变时,溶液久置后不分层,也不析出固体。3.溶液的组成溶液是由溶质(状态:固、液、气)和溶剂(不一定是水)组成的。溶质:___________的物质;溶剂:能________其他物质的物质。被溶解溶解溶液质量=溶质质量+溶剂质量,但溶液体积≠溶质体积+溶剂体积。4.溶液的分类饱和溶液不饱和溶液(1)依据是否可以继续溶解溶质分为__________________和________________。(2)依据溶液中含溶质多少分为浓溶液和稀溶液。5.饱和溶液与不饱和溶液(1)定义:表示在一定温度下,向一定量溶剂里加入某种溶质,当该溶质______________时所得的溶液叫做这种溶质的饱和溶液。当该溶质________________时所得的溶液叫做这种溶质的不饱和溶液。不能继续溶解还能继续溶解溶质(2)检验:判断溶液是否饱和的方法是往溶液中继续加入________,看是否能继续溶解。6.饱和溶液与溶液稀浓的关系无饱和溶液与溶液稀浓________(填“有”或“无”)直接关系。饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液,但某物质在一定温度下的饱和溶液一定比该物质在该温度下的不饱和溶液浓度大。温馨提示有均一性和稳定性的液体不一定是溶液,如蒸馏水;溶液一般是澄清透明的,但不一定是无色的,如硫酸铜溶液为蓝色,高锰酸钾溶液为紫色。考点二溶解度1.固体的溶解度固体的溶解度表示在一定__________下,某固态物质在________溶剂里达到________状态时所溶解的________。在溶质和溶剂确定的前提下,固体溶解度只受_______影响。温度100g饱和质量温度2.固体溶解度曲线(1)溶解度曲线表示溶解度随________变化趋势的曲线,纵坐标表示________,横坐标表示________。(2)固体溶解度曲线表示的信息:①某温度下物质的溶解度;②物质溶解度随温度变化的趋势;③交点的意义:某温度时的两种或多种物质溶解度______(一定要指明温度)。溶解度温度相等温...