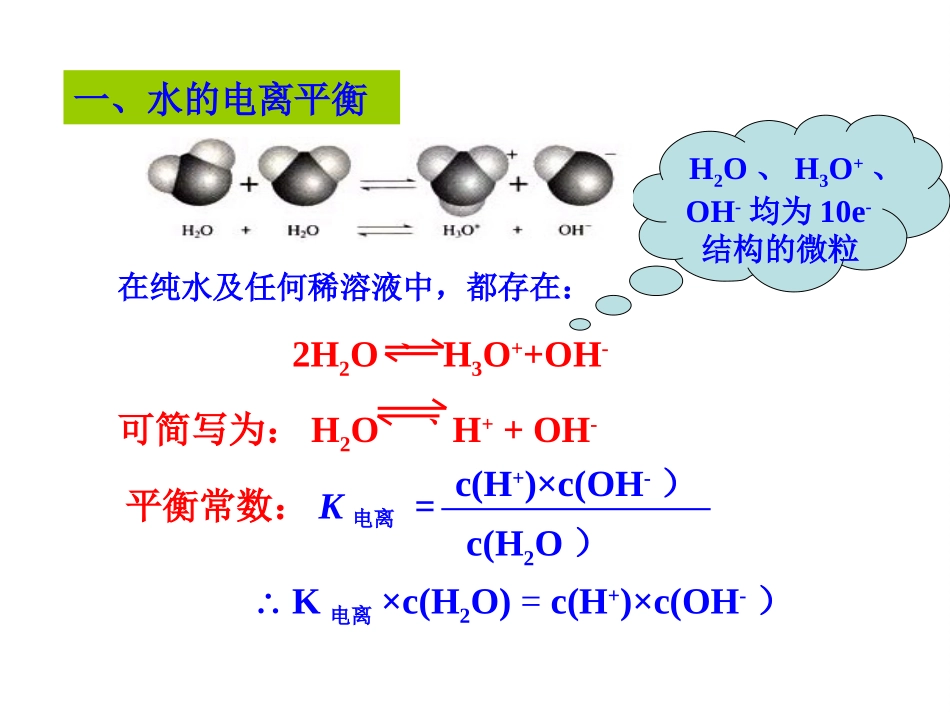
水乃生命之源,我们对水又了解多少呢?第二节水的电离和溶液的酸碱性第1课时水的电离溶液的酸碱性与pH如图,是一个电解水的装置。在做这个实验时往往在水中加入几滴稀硫酸,以增强水的导电性。难道纯水真的不导电吗?精确的实验证明:精确的实验证明:水是一种极弱的电解质,它能在水中微弱的电离,生成H3O+(水合氢离子)和OH-.请同学们写出水的电离方程式请同学们写出水的电离方程式研究电解质溶液时往往涉及到溶液的酸碱性.电解质溶液的酸碱性跟水的电离有密切的关系.为了从本质上认识溶液的酸碱性,就要了解水的电离情况.在纯水及任何稀溶液中,都存在:2H2OH3O++OH-可简写为:H2OH++OH-平衡常数:K电离=c(H+)×c(OH-)c(H2O)H2O、H3O+、OH-均为10e-结构的微粒一、水的电离平衡∴K电离×c(H2O)=c(H+)×c(OH-)水的电离极其微弱,25℃时1升纯水为55.6mol,发生电离的水只有1×10-7mol,电离前后水的物质的量几乎不变,c(H2O)可以视为常数。常数乘以常数为一个新的常数,用Kw表示,称为水的离子积常数,简称水的离子积。水的离子积:KW=c(H+)×c(OH-)∴K电离×c(H2O)=c(H+)×c(OH-)升高温度,水的电离平衡向右移动,电离程度增大,Kw越大。水的电离是吸热过程。升高温度,促进水的电离,Kw增大。Kw只与温度有关,与浓度无关。Kw=Kw=2525℃℃::C(HC(H++)=C(OH)=C(OH--)=1×10)=1×10-7-7mol/Lmol/L1×101×10-14-1410010000CC::C(HC(H++)=C(OH)=C(OH--)=)=7.4×107.4×10--77mol/Lmol/LKw=Kw=5.5×105.5×10-13-13注意哪!注意哪!水的电离是吸热过程,温度越高,平衡右移,电离程度越大。促进水的电离(2)酸:加入少量的酸,C(H+)升高,平衡左移,电离程度减小。抑制水的电离(3)碱:加入少量的碱,C(OH-)升高,平衡左移,电离程度减小。抑制水的电离(4)盐(第三节学习)二、影响水的电离平衡的因素小结:酸碱抑制水的电离,加热促进水的电离(1)温度:例1、25℃纯水电离出的c(H+)?100℃时,纯水电离出的c(H+)的变化呢?例2、由上述数据可知,100℃时,水呈酸性,这种说法对吗?为什么?1×101×10-7-7mol/L>>1×101×10-7-7mol/L【问题】:0.01mol/L的盐酸中有OH-吗?0.01mol/L的NaOH溶液中有H+吗?如果有,则它们的浓度分别为多少呢?不对。不对。100100℃时,水电离出的C(H+)=C(OH-),仍为中性。体会体会::(2)影响水的离子积常数主要是温度。当温度不变时,Kw不变。酸性或碱性溶液中,常温下酸性或碱性溶液中,常温下KwKw仍为仍为1×101×10--1414。。(1)酸性或碱性溶液中Kw表达式变化为:Kw=CKw=CHH++((aqaq))××CCOHOH--(aq)(aq)三、溶液的酸碱性和pH在常温时,由于水的电离平衡的存在,不仅是纯水,就是在酸性和碱性的稀溶液里,H+的浓度和OH-的浓度的乘积也总是一个常数。故酸性和碱性的稀溶液中水的离子积Kw仍等于1×10-1425℃时,蒸馏水中c(H+)和c(OH-)各是多少?向其中加入少量的盐酸或者NaOH溶液,c(H+)和c(OH-)如何变化?对水的电离平衡有何影响?10-710-7c(H+)=c(OH-)中性>10-7<10-7c(H+)>c(OH-)酸性左移<10-7>10-7c(H+)<c(OH-)碱性左移1、常温时,溶液的酸碱性与C(H+)和C(OH-)的关系:中性溶液:C(H+)=1×10-7mol/LpH=7酸性溶液:C(H+)>C(OH-)C(H+)>1×10-7mol/LpH<7C(H+)=C(OH-)碱性溶液:C(H+)7问题:表述溶液的酸碱性时有哪些方法?问题:表述溶液的酸碱性时有哪些方法?哪种更准确?哪种更准确?当C(H+)很小时,用来表示溶液的酸碱性的强弱时,很不方便。化学上常采用pH来表示溶液酸碱性强弱。定义:当溶液的当溶液的CC((HH++)或)或CC((OHOH--)>)>11mol/L时,用pH表示不方便且为负数,故直接用C(H+)或C(OH-)表示溶液的酸碱性强弱。表示稀溶液中溶液酸碱性的一种方法2、pHpH=-lg[C(H+)]pH01234567891011121314pH越小,酸性增强中性pH越大,碱性增强25℃pH值与酸、碱性的关系?C(H+)10.10.01……10-7……10-14下列溶液中,肯定呈酸性的是()A.含H+的溶液B.pH<7的溶液C.c(OH-)