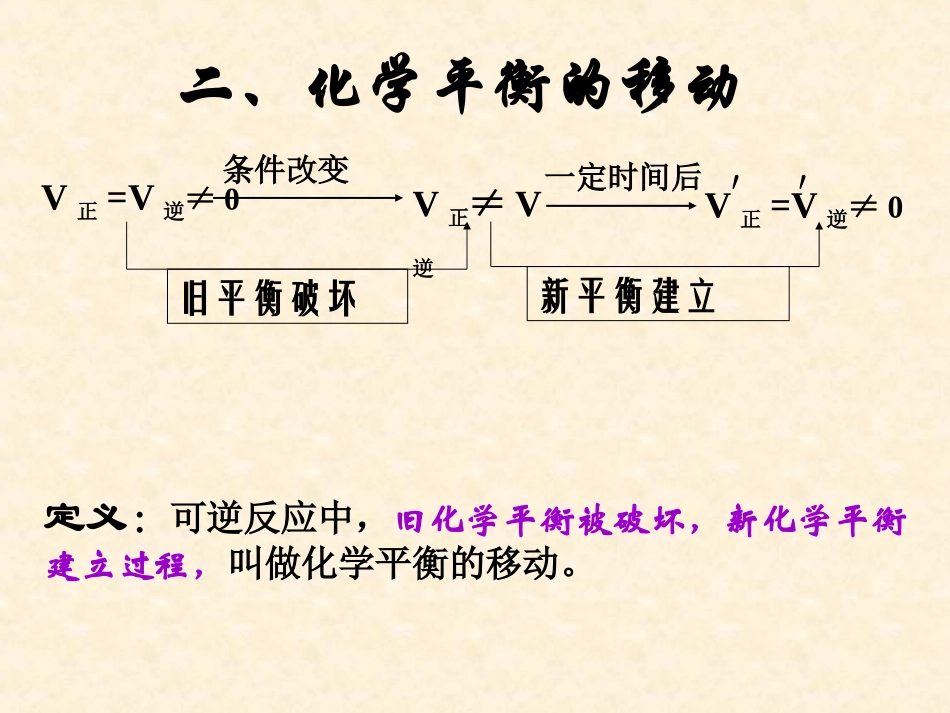
第三节化学平衡第二章化学反应速率与化学平衡第二章化学反应速率与化学平衡第二课影响化学平衡移动的因第二课影响化学平衡移动的因素素化学平衡状态的特征(3)动:反应未终止,是动态平衡(v(正)=v(逆)≠0)(1)逆:化学平衡的研究对象是可逆反应(4)定:反应混合物中各组分的浓度保持一定,各组分的含量保持不变。(5)(5)变:改变影响平衡的外界条件,旧平变:改变影响平衡的外界条件,旧平衡会发生改变,从而建立新的化学平衡。衡会发生改变,从而建立新的化学平衡。(2)等:v(正)=v(逆)(以同一物质为标准)定义:可逆反应中,旧化学平衡被破坏,新化学平衡建立过程,叫做化学平衡的移动。V正=V逆≠0V正≠V逆条件改变新平衡建立旧平衡破坏V正=V逆≠0′′一定时间后二、化学平衡的移动平衡向正反应方向移动。平衡不移动。平衡向逆反应方向移动。正逆反应速率与平衡移动的方向:①若V正>V逆,③若V正=V逆,②若V正<V逆,【思考与交流】有哪些条件能改变化学平衡呢?一、浓度对化学平衡的影响(P26)溶液橙色加深溶液黄色加深•实验探究(P27实验2-6)Fe3++3SCN-Fe(SCN)3现象:溶液变成红色(血红色)(无色)(黄色)A.加少量饱和FeCl3溶液:B.加少量浓KSCN溶液:C.在上述两支试管中加少量NaOH溶液:有红褐色沉淀生成,溶液红色变浅红色加深;红色加深;实验结论:实验结论:在其他条件不变时,增大反应物或减小生成物的浓度化学平衡向正反应方向移动减小反应物或增大生成物的浓度化学平衡向逆反应方向移动浓度对化学平衡移动的几个注意点①平衡体系中的固体和纯液体,其浓度可看作一个常数,他们的改变,不会影响化学平衡的移动。②只要是增大浓度(反应物还是生成物),新平衡状态下的反应速率一定大于原平衡状态;减小浓度,新平衡状态下的速率一定小于原平衡状态。③反应物有两种或两种以上,增加一种物质的浓度,其他物质的转化率提高,而该物质的平衡转化率却降低。二、压强对化学平衡的影响:N2十3H22NH3NH3%随着压强增大而增大,即平衡向正反应方向移动。压强(MPa)15103060100NH3%2.09.216.435.553.669.42SO3O2十2SO2压强(MPa)0.10.51.010SO3分解率26.314.210.54.6SO3的分解率随着压强增大而减小,即平衡向逆反应方向移动。实验结论:实验结论:在其他条件不变时,增大压强,化学平衡向气体体积减小的方向移动减小压强,化学平衡向气体增大的方向移动如果反应前后气体体积不变,改变压强,正逆反应速率同时同比例改变,则平衡不移动。练习1、反应NH4HS(s)NH3(g)+H2S(g)在一定条件下达到平衡,不能使平衡移动的是()AT、V不变时,通入SO2气体B移走部分NH4HS固体CV不变,充入N2D充入N2,保持压强不变BC练习2、在一个密闭容器中,发生反应aA(g)bB(g)平衡后,保持温度不变,容器的体积增大一倍,达到新的平衡时,B的浓度变为原来的60%,则()A平衡向正向移动BA的转化率减小CB的质量分数增大Da>bAC2NO2NO22NN22OO44H<0△H<0△红棕色红棕色无色无色实验实验22--77气体的颜色平衡移动的方向热水冷水加深加深平衡逆向移动平衡逆向移动变浅变浅平衡正向移动平衡正向移动三、温度对化学平衡的影响:三、温度对化学平衡的影响在其它条件不变的情况下:A:升高温度,化学平衡向着吸热反应的方向移动;B:降低温度,化学平衡向着放热反应的方向移动。实验结论:实验结论:四、催化剂对化学平衡的影响:催化剂的加入,能同等程度改变正逆反应速率,所以它只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。能量反应过程E1E2反应物生成物活化分子反应热加了催化剂[总结]改变反应条件时平衡移动的方向增大反应物浓度向正反应方向移动减小反应物浓度向逆反应方向移动增大压强向气体体积缩小的方向移动减小压强向气体体积增大的方向移动升高温度向吸热反应方向移动向放热反应方向移动降低温度改变反应条件平衡移动方向加催化剂平衡不移动注意:是减弱,但不能抵消。注意:是减弱,但不能抵消。如果影响平衡的外界条件发生改变(如浓度、压强、或温度)等,平衡就向能减弱减弱这种改变的方向移动。平衡移动原理(勒夏特列原理):是阻碍,但不是阻止。是阻碍,但不是阻止。外界条件和平...