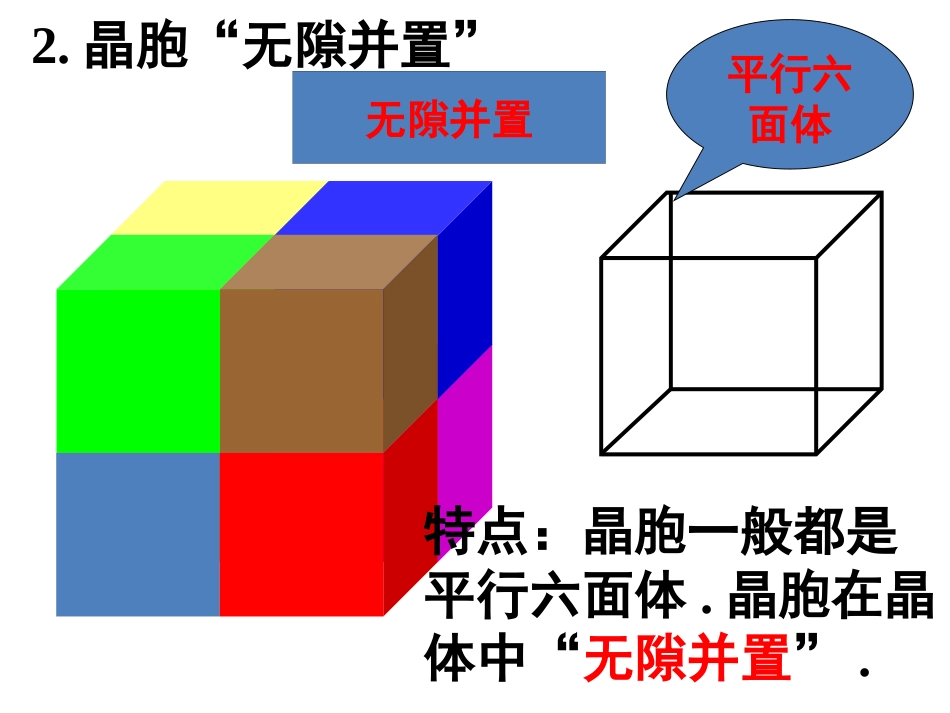
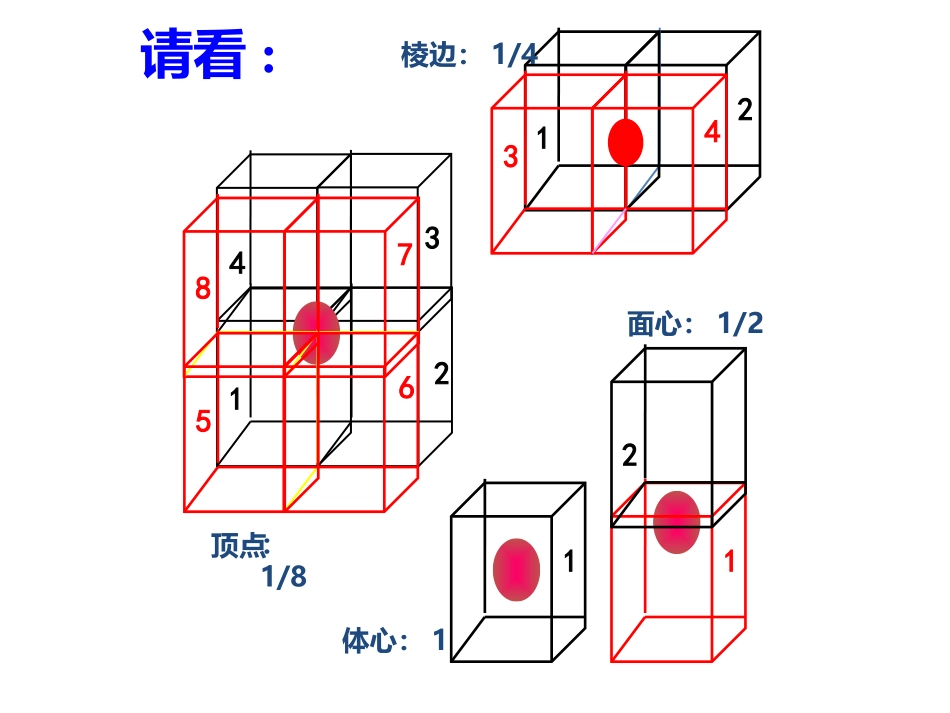
平行六面体无隙并置特点:晶胞一般都是平行六面体.晶胞在晶体中“无隙并置”.2.晶胞“无隙并置”12437685122134请看:1体心:1面心:1/2顶点棱边:1/4:1/8均摊法:如某个粒子为x个晶胞所共有,则该粒子有1/x属于一个晶胞。(二)晶胞中原子个数的计算二、晶胞立方晶胞中粒子个数的计算规律立方晶胞第一节晶体的常识2.正六棱柱晶胞1/21/41/6面心:(上、下)棱:顶点:侧棱:1/3正六棱柱晶胞/31/21/41/6面心:(上、下)棱:顶点:侧棱:1/31/61/12金属Zn所含原子数:4×1/6+4×1/12+1=2正六棱柱晶胞/61/21/4面心:(上、下)棱:顶点:侧棱:1/61/12(1)平均每个正六边形拥有_____个锗原子,_____个氧原子.23√晶体化学式确定——根据均摊法计算出1个晶胞内不同微粒的个数最简整数比所含碳原子数:6×4×1/3=8BO-2√所含X原子数:6×1/3=2所含X原子数:6×1/2=322:3所含碳原子数:6×1/3=2已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图所示:其中有二十个等边三角形的面和一定数目的顶点,每个顶点为一个硼原子,试通过观察分析右图回答:此基本结构单元是由___个硼原子构成,有___个B-B化学键,相邻B-B键的键角为____.1230600所含B原子数:20×3×1/5=12所含B-B化学键数:20×3×1/2=30或12×5×1/2=30已知晶体的基本单元是由12个硼原子构成的(如下图),每个顶点上有一个硼原子,每个硼原子形成的化学键完全相同,通过观察图形和推算,可知此基本结构单元是一个正____面体。20所含面数:12×5×1/3=20(3)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为________。2BN所含B(白球)原子数:4×1/12+4×1/6+1=2所含N(黑球)原子数:2×1/6+2×1/3+1=2晶体密度的计算晶体微粒与M、ρ之间的关系:若1个晶胞中含有x个微粒,则1mol晶胞中含有xmol微粒,其质量为xMg(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3g(a3为晶胞的体积,ρ为晶胞的密度),则1mol晶胞的质量为ρa3NAg,因此有xM=ρa3NA√√(1)在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的氧离子、钙离子、钛离子各有________个、________个、________个。(2)该晶体结构中,元素氧、钛、钙的离子个数比是________,该物质的化学式可表示为________。(3)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为___g·cm-3。【答案】(1)686(2)3∶1∶1CaTiO3(3)a+b+3c602d3(4)某晶体结构模型如图所示。该晶体的化学式是________,在晶体中1个Ti原子,1个Co原子周围距离最近的O原子数目分别为________个、________个。6122.如图为甲、乙、丙三种晶体的晶胞。试完成下列问题:(1)甲晶体的化学式(X为阳离子)为________。(2)乙晶体中A、B、C三种微粒的个数比是________。(3)丙晶体中每个D周围结合E的个数是________。【答案】(1)X2Y(2)1∶3∶1(3)81、概念:只含分子的晶体称为分子晶体。2、构成微粒:分子熔点低、易升华、硬度小分子晶体决定分子晶体的熔、沸点导电性:通常,晶体本身不导电,熔融状态也不能导电。分子晶体分子内的原子之间分子之间共价键分子间作用力(范德华力、氢键,较弱)3、晶体中微粒间的作用力4、分子晶体物理性质的共性:√√5、常见的分子晶体(1)所有非金属氢化物,如水、硫化氢、氨、氯化氢、甲烷等;(2)部分非金属单质,如卤素(X2)、氧(O2)、硫(S8)、氮(N2)、白磷(P4)、碳60(C60)、稀有气体等;(3)部分非金属氧化物,如CO2、P4O6、P4O10、SO2等;(4)几乎所有的酸;(5)绝大多数有机物的晶体,如乙醇、冰醋酸、蔗糖。以下晶体中哪些属于分子晶体?S、H2SO4、C60、尿素、He、NH3、SiO2、SO2、P4O6、P、Cl2、C(金刚石)、H2S、冰醋酸判断标准----只含分子√√√√√√√√√√√√想一想6、分子晶体的结构特征(1)分子间只有范德华力分子密堆积:每个分子周围有12个紧邻的分子如:C60、干冰、O2(2)分子间有氢键分子非密堆积:氢键具有方向性,使晶体中的空间利用率不高,留有相当大的空隙。如:HF、NH3、...