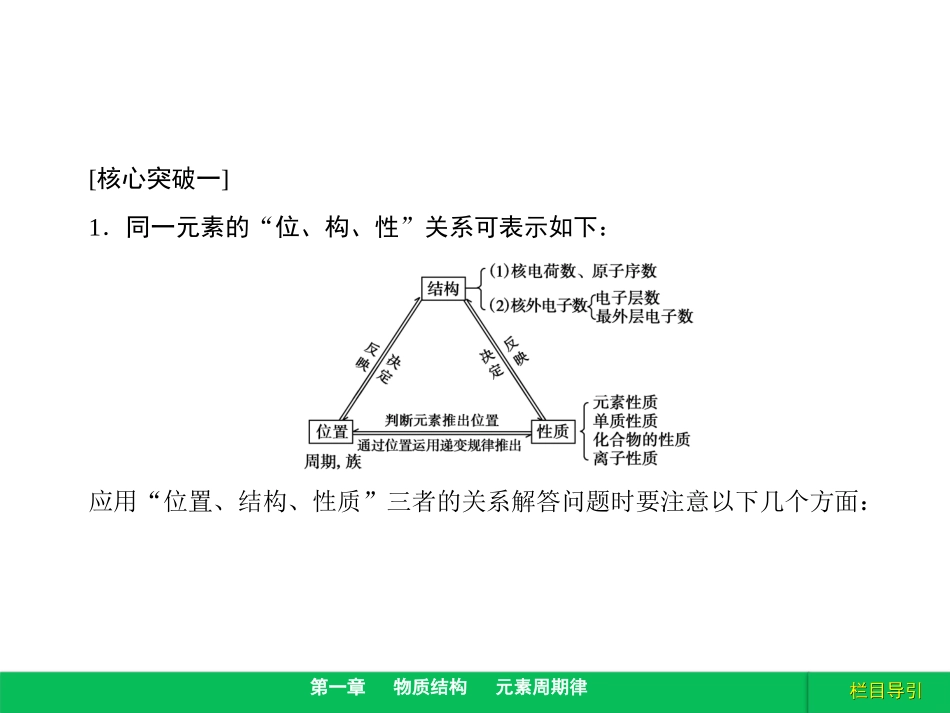
栏目导引栏目导引第一章物质结构元素周期律[核心突破一]1.同一元素的“位、构、性”关系可表示如下:应用“位置、结构、性质”三者的关系解答问题时要注意以下几个方面:栏目导引栏目导引第一章物质结构元素周期律(1)原子结构――→决定元素在周期表中的位置结构最外层电子数=主族序数电子层数=周期数位置(2)原子结构――→决定元素的化学性质①最外层电子数越少,电子层数越多→越易失电子,单质的还原性越强。②最外层电子数越多,电子层数越少→越易得电子,单质的氧化性越强。栏目导引栏目导引第一章物质结构元素周期律(3)元素在周期表中的位置――→体现或推测原子结构和元素性质同周期:[从左到右位置]――――――――――――――→最外层电子数递增结构非金属性增强,金属性减弱性质同主族:[从上到下位置]――――――――――――――→电子层数递增结构金属性增强,非金属性减弱性质(4)元素“位、构、性”规律中的特例①绝大多数原子的原子核是由质子和中子构成的,只有氕(11H)无中子。②元素周期表中的周期一般都是从金属元素开始,但第一周期例外,是从氢元素开始的。栏目导引栏目导引第一章物质结构元素周期律③所有元素中,碳元素形成的化合物种类最多。④非金属单质一般不导电,但石墨导电,晶体硅是半导体。⑤氟无正价,氧无最高正价;在Na2O2中氧显-1价,在NaH中氢显-1价。警示:(1)只有主族元素的最外层电子数等于主族序数。(2)难得电子的原子不一定易失电子,如稀有气体原子。栏目导引栏目导引第一章物质结构元素周期律(5)推断陌生元素性质时要从以下三个角度分析①与同周期前、后元素相比较,依据同周期元素性质的递变规律推测元素的性质。②与同主族上、下元素相比较,依据同主族元素性质的递变规律推测元素的性质。③比较不同周期、不同主族元素的性质时,可借助“三角”规律进行推断。栏目导引栏目导引第一章物质结构元素周期律若A、B、C三种元素位于元素周期表中如图1.2-4所示位置,有关元素的各种性质均可排出顺序(但D不能参与排序)。a.原子半径:C>A>B;b.金属性:C>A>B;c.非金属性:B>A>C。图1.2-4栏目导引栏目导引第一章物质结构元素周期律[核心突破二]元素推断题的“突破口”(1)主族元素在周期表中的特殊位置①族序数等于周期数的元素:H、Be、Al。②族序数等于周期数2倍的元素:C、S。③族序数等于周期数3倍的元素:O。④周期数是族序数2倍的短周期元素:Li。栏目导引栏目导引第一章物质结构元素周期律⑤周期数是族序数3倍的短周期元素:Na。⑥最高正价与最低负价代数和为零的短周期元素:H、C、Si。⑦最高正价是最低负价绝对值3倍的短周期元素:S。⑧除H外,原子半径最小的元素:F。⑨最高价不等于族序数的元素:O、F。栏目导引栏目导引第一章物质结构元素周期律(2)主族元素性质、存在和用途的特殊性①形成化合物最多的元素(或单质是自然界硬度最大的元素、气态氢化物中氢的质量分数最大的元素):C。②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。③氢化物在通常状况下呈液态的元素:O。栏目导引栏目导引第一章物质结构元素周期律④最活泼的非金属元素(或无含氧酸的非金属元素、其无氧酸可腐蚀玻璃的元素、其气态氢化物最稳定的元素、阴离子的还原性最弱的元素):F。⑤最高价氧化物对应水化物酸性最强的元素:Cl。⑥最易着火的非金属元素的单质,其元素是:P。⑦最轻单质所含的元素:H。最轻金属单质所含的元素:Li。栏目导引栏目导引第一章物质结构元素周期律⑧单质常温下呈液态的元素:Br、Hg。⑨最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。⑩元素的气态氢化物和它的最高价氧化物的水化物起化合反应的元素:N。⑪元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。⑫常见的能形成同素异形体的元素:C、P、O、S。栏目导引栏目导引第一章物质结构元素周期律栏目导引栏目导引第一章物质结构元素周期律1.对于主族元素(1)周期序数=电子层数(2)主族序数=最外层电子数=最高正价=8-|最低负价|(其中,F无正价,O无最高正价)。2.金属...