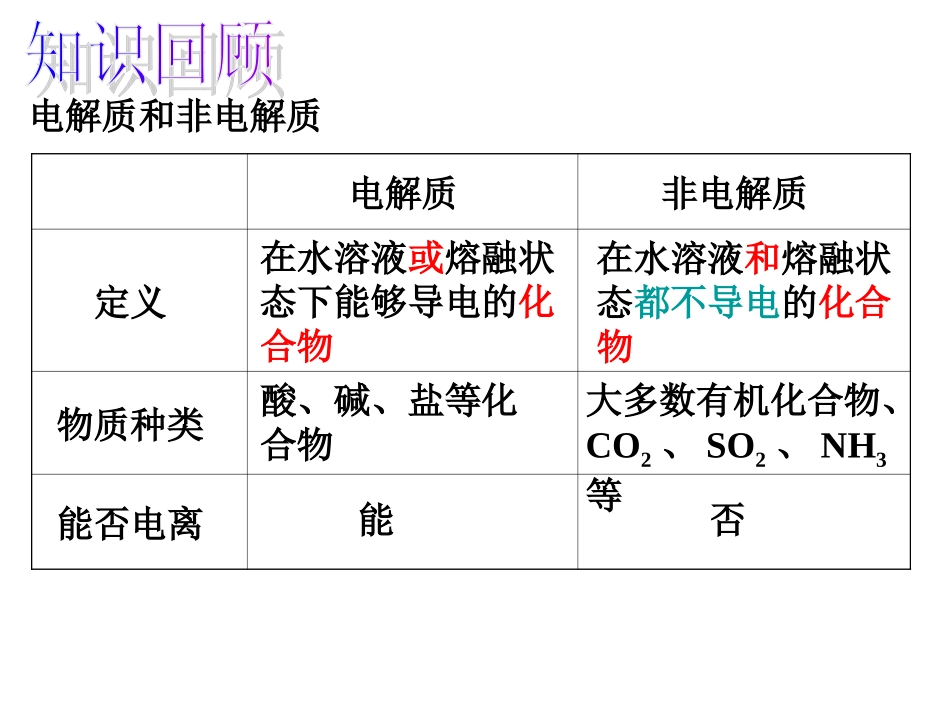
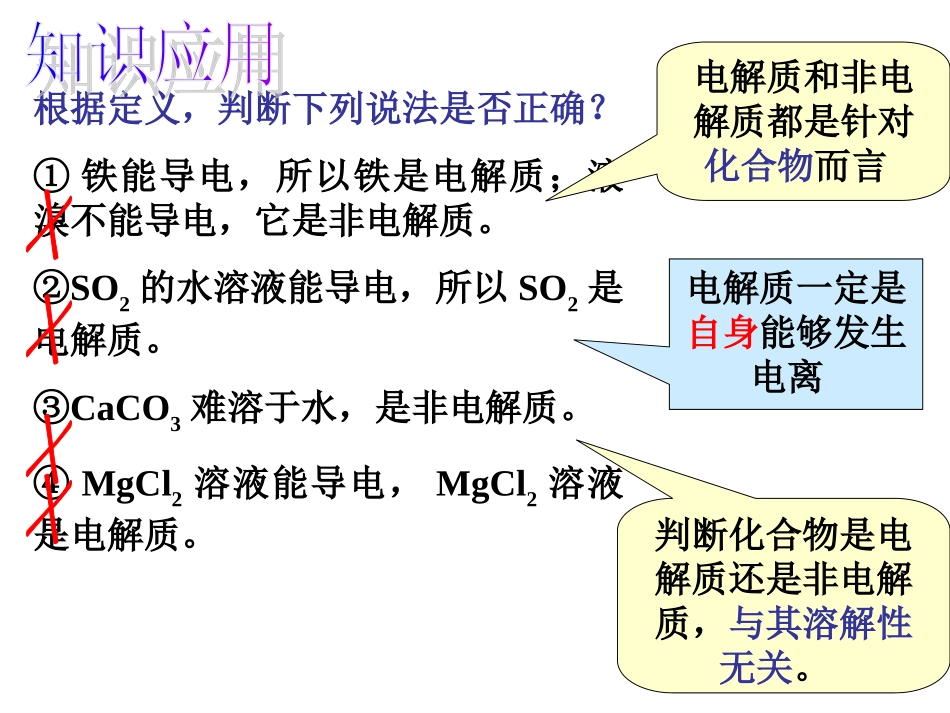
电解质和非电解质电解质非电解质定义物质种类能否电离在水溶液或熔融状态下能够导电的化合物在水溶液和熔融状态都不导电的化合物酸、碱、盐等化合物大多数有机化合物、CO2、SO2、NH3等能否根据定义,判断下列说法是否正确?①铁能导电,所以铁是电解质;液溴不能导电,它是非电解质。②SO2的水溶液能导电,所以SO2是电解质。③CaCO3难溶于水,是非电解质。④MgCl2溶液能导电,MgCl2溶液是电解质。电解质和非电解质都是针对化合物而言电解质一定是自身能够发生电离判断化合物是电解质还是非电解质,与其溶解性无关。[活动与探究]比较相同条件下,浓度为0.5mol/L的醋酸、盐酸、食盐水、NaOH溶液、氨水、蒸馏水的导电能力(1)实验现象:(2)实验结论:思考:电解质的导电能力是否一致呢?思考:电解质的导电能力是否一致呢?盐酸、食盐水、NaOH溶液灯泡较亮;醋酸、氨水灯泡较暗;蒸馏水不亮。相同物质的量浓度盐酸、食盐水、NaOH溶液导电能力强,醋酸、氨水、蒸馏水导电能力弱H2OH+Cl-H2OCH3COOHH+CH3COO-盐酸溶液醋酸溶液HCl在水中全部电离CH3COOH在水中部分电离强酸强碱大部分盐活泼金属氧化物弱酸弱碱水电解质强电解质弱电解质是否完全电离一、强电解质和弱电解质强电解质——在水溶液中全部电离。弱电解质——在水溶液中部分电离。1.定义2.分类下列物质属于强电解质的是(),属于弱电解质的是(),属于非电解质的是(),能够导电的是()。①铜②一水合氨③氯化钠固体④硝酸钾溶液⑤碳酸钙⑥二氧化碳⑦蔗糖⑧冰醋酸⑨液态KNO3⑩液态HCl③⑤⑨⑩②⑧⑥⑦①④⑨3.电离和电离方程式⑴电离电解质在水溶液中或熔融状态下离解出自由移动的离子的过程。⑵电离方程式:[思考]试写出H2CO3,HClO,碳酸氢钠的电离方程式?例如:CH3COOHCH3COO-+H+二、离子反应[思考]下列反应能发生吗?CuSO4溶液+BaCl2溶液:CuSO4溶液+NaCl溶液:反应不反应NaCl=Na++Cl-CuSO4=Cu2++SO42-CuSO4=Cu2++SO42-BaCl2=Ba2++2Cl-(1)中反应的实质是SO42-和Ba2+的反应,Cu2+和Cl-在溶液中没变化混合前混合后SO42-Cu2+混合前混合后Cl-Ba2+BaSO4Cu2+Cl-Na+Cl-Cu2+SO42-Na+Cl-Cu2+SO42-NaCl溶液与AgNO3溶液混合反应:NaCl溶液与AgNO3溶液混合反应:1、离子反应有离子参加的反应。2、离子反应发生的条件①生成难溶物②生成弱电解质③生成挥发性物质④发生氧化还原反应3、离子反应方程式用实际参加反应的离子的离子符号来表示的方程式。4、离子反应方程式的书写(1)写(2)改(3)删(4)查——写出化学方程式①易溶于水、易电离物质(强酸、强碱、可溶性盐)——写离子形式②难溶于水、难电离物质(弱电解质)——写化学式③单质、气体、氧化物——写化学式——删去方程式两边不参加反应的离子——查原子个数、查电荷4、离子反应方程式的书写(注意:不是在溶液中进行的反应,不能用离子方程式表示。)练习:在强碱性无色溶液中下列离子能否大量共存?A.Ba2+、K+、HCO3-、Cl-B.NH4+、K+、Cl-、MnO4-C.K+、Na+、Al3+、Cl-D.Mg2+、Na+、SO42-、Cl-E.CO32-、Na+、Ba2+、NO3-(离子间在溶液中若能发生离子反应,则这些离子不能大量共存。)(×)(×)(×)(×)(×)5、离子共存问题