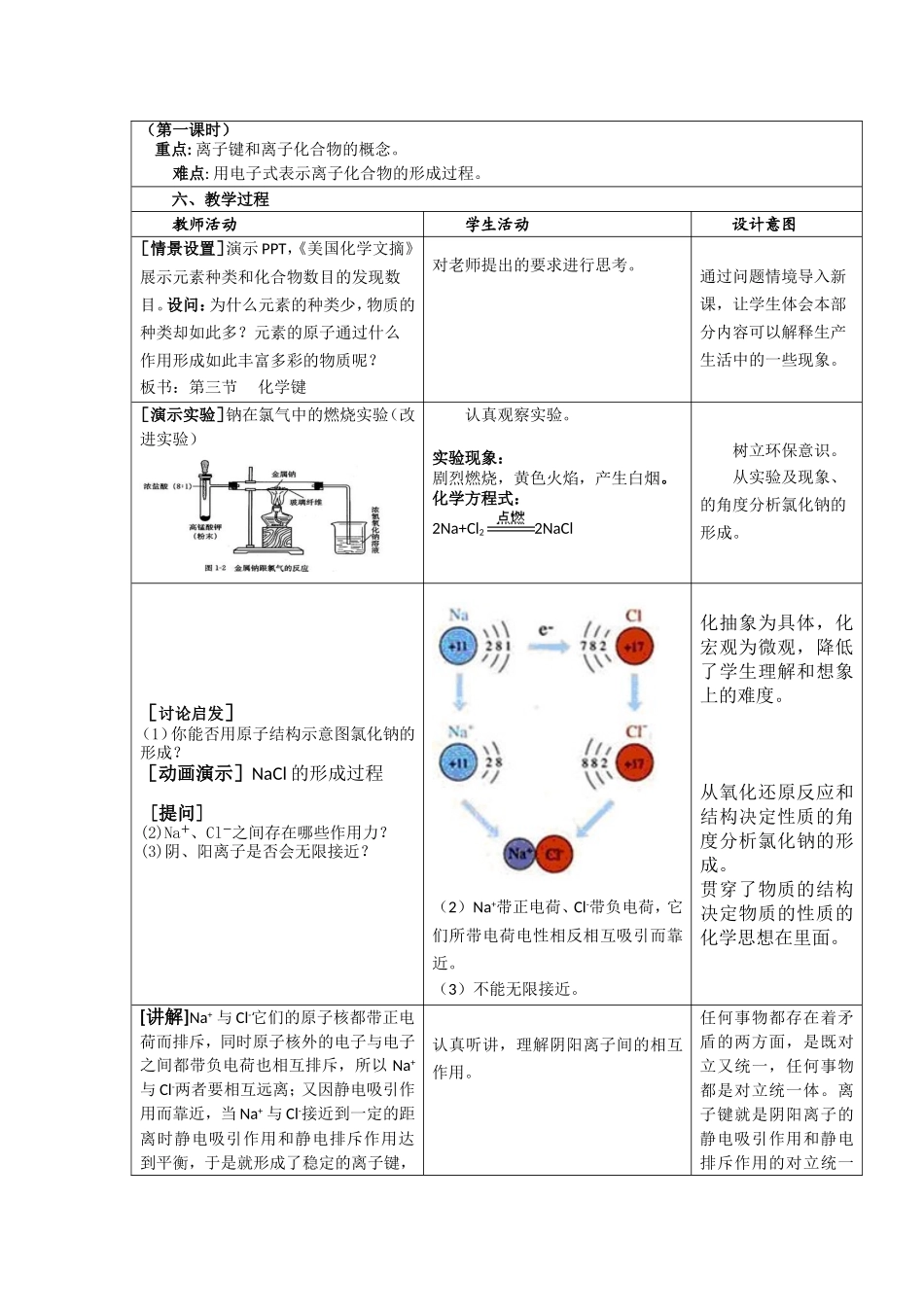
课题:化学键科目高中化学教学对象高一课时1提供者贾青青单位太谷二中一、教学目标知识与技能:1.理解离子键和离子化合物的概念,会判断一种物质是否是离子化合物。2.理解离子键的形成过程和形成条件。3.熟练运用电子式表示离子化合物的形成过程。过程与方法:1.通过对化学键的学习,学会用对立统一规律认识问题。2.掌握由个别到一般的研究问题的方法,学习由宏观到微观、从现象到本质的认识事物的科学方法。情感、态度与价值观:1.通过创设问题情境,激发探究化学反应本质的好奇心,逐渐培养学生积极思维勇于探索的学习品质;2.通过离子键形成过程的分析,培养怀疑、求实、创新的精神。二、教学内容及模块整体分析地位:“化学键”是人教版版高一化学必修二教材第一章第三节的内容。本节内容属基础理论知识中物质结构的范畴,它从原子的结构来阐述分子的结构,使学生充分认识到化学是在原子、分子水平上研究物质的组成、结构、性质及其应用的一门基础自然科学这一本质,不仅是本章的重点,还是整个中学化学的重点。作用:承前启后。本节内容既是对“原子结构元素周期律”相关内容的提升和拓展,又为之后学习《物质结构与性质》(选修3)奠定了必要的理论知识基础。只有通过对本节内容的学习,才能真正打开运用基础理论知识系统性地学习元素及其性质的科学大门。主要内容:离子键。离子化合物。电子式的表示方法。三、学情分析学生知识情况:在本章前两节已经学习了原子结构、元素周期表和元素周期律,学生可以在了解原子结构的基础上去探究物质(离子化合物、共价分子)的结构,在知道元素及其化合物周期性性质的基础上去推断物质的结构。学生能力情况:具备初步微观想象能力和一定的空间想象力。学生“心理特征”分析:高一学生已具备一定的自主思考能力,遇到问题会自己想办法解决,适时给他们提出一些问题,有助于激发他们的好奇心,产生学习化学的兴趣。四、教学策略选择与设计问题探究法:作为物质组成的重要理论,化学键是一个纯理论、极其抽象的知识,对于学生来说,化学键没有实验验、没有具体的感官认知,是个完全陌生的领域。所以要创设问题情境,调动学生内在的认知需求,激发学生的学习动机,并引导学生积极思考。通过物质种类与元素种类的巨大区别引出原子之间通过一定的作用力相结合。实验探究法:通过实验“钠与氯气的反应”。动画展示法:通过“钠与氯、氢与氯如何结合形成稳定的化合物”的动画展示离子键和共价键的实质。讲授法:电子式的表示方法。对比总结法:对比总结离子键与共价键的异同,区分离子化合物和共价化合物。五、教学重点及难点(第一课时)重点:离子键和离子化合物的概念。难点:用电子式表示离子化合物的形成过程。六、教学过程教师活动学生活动设计意图[情景设置]演示PPT,《美国化学文摘》展示元素种类和化合物数目的发现数目。设问:为什么元素的种类少,物质的种类却如此多?元素的原子通过什么作用形成如此丰富多彩的物质呢?板书:第三节化学键对老师提出的要求进行思考。通过问题情境导入新课,让学生体会本部分内容可以解释生产生活中的一些现象。[演示实验]钠在氯气中的燃烧实验(改进实验)认真观察实验。实验现象:剧烈燃烧,黄色火焰,产生白烟。化学方程式:2Na+Cl22NaCl树立环保意识。从实验及现象、的角度分析氯化钠的形成。[讨论启发](1)你能否用原子结构示意图氯化钠的形成?[动画演示]NaCl的形成过程[提问](2)Na+、Cl-之间存在哪些作用力?(3)阴、阳离子是否会无限接近?(2)Na+带正电荷、Cl-带负电荷,它们所带电荷电性相反相互吸引而靠近。(3)不能无限接近。化抽象为具体,化宏观为微观,降低了学生理解和想象上的难度。从氧化还原反应和结构决定性质的角度分析氯化钠的形成。贯穿了物质的结构决定物质的性质的化学思想在里面。[讲解]Na+与Cl-它们的原子核都带正电荷而排斥,同时原子核外的电子与电子之间都带负电荷也相互排斥,所以Na+与Cl-两者要相互远离;又因静电吸引作用而靠近,当Na+与Cl-接近到一定的距离时静电吸引作用和静电排斥作用达到平衡,于是就形成了稳定的离子键,认真听讲,理解阴...