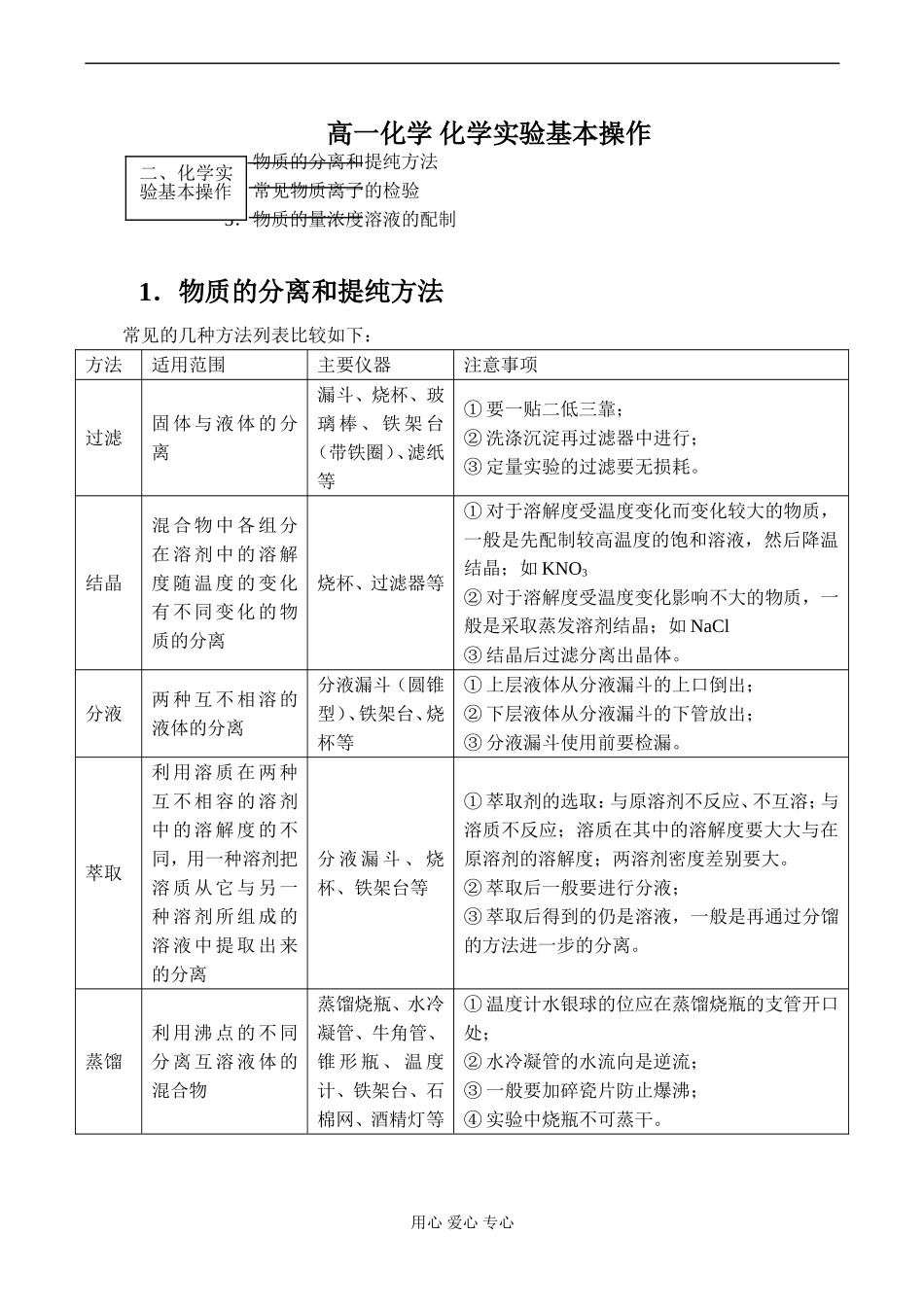
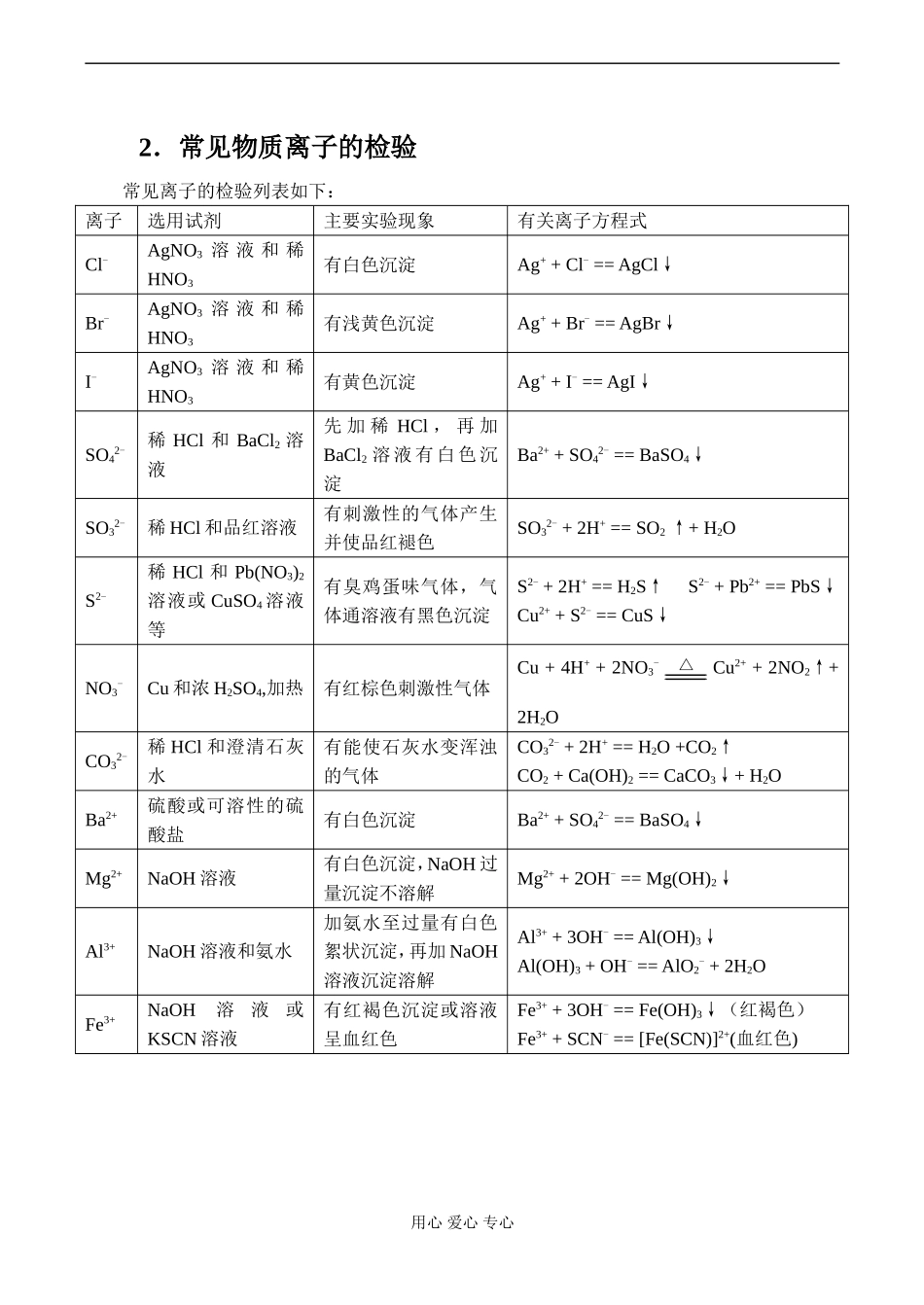
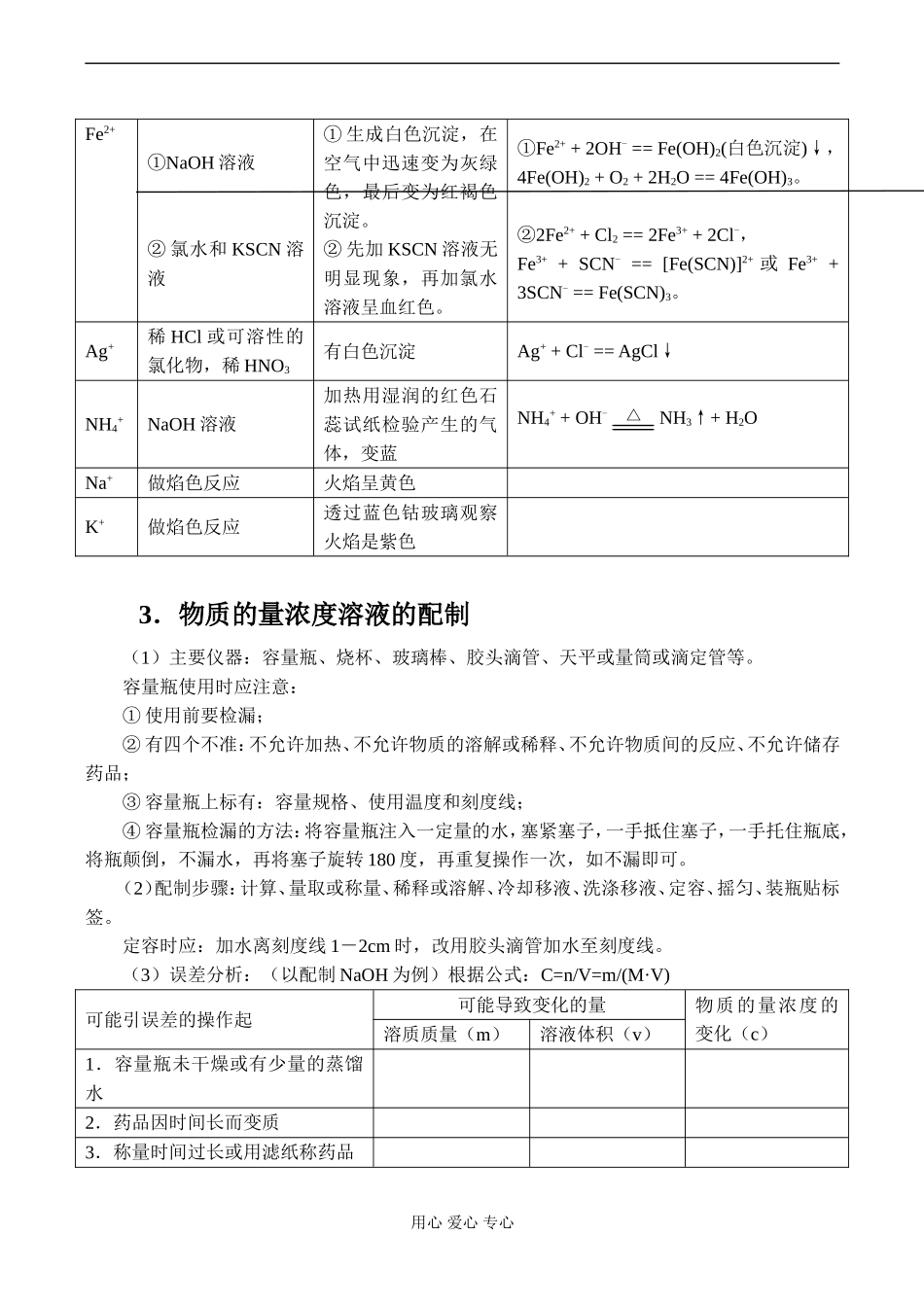
高一化学化学实验基本操作1.物质的分离和提纯方法2.常见物质离子的检验3.物质的量浓度溶液的配制1.物质的分离和提纯方法常见的几种方法列表比较如下:方法适用范围主要仪器注意事项过滤固体与液体的分离漏斗、烧杯、玻璃棒、铁架台(带铁圈)、滤纸等①要一贴二低三靠;②洗涤沉淀再过滤器中进行;③定量实验的过滤要无损耗。结晶混合物中各组分在溶剂中的溶解度随温度的变化有不同变化的物质的分离烧杯、过滤器等①对于溶解度受温度变化而变化较大的物质,一般是先配制较高温度的饱和溶液,然后降温结晶;如KNO3②对于溶解度受温度变化影响不大的物质,一般是采取蒸发溶剂结晶;如NaCl③结晶后过滤分离出晶体。分液两种互不相溶的液体的分离分液漏斗(圆锥型)、铁架台、烧杯等①上层液体从分液漏斗的上口倒出;②下层液体从分液漏斗的下管放出;③分液漏斗使用前要检漏。萃取利用溶质在两种互不相容的溶剂中的溶解度的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的分离分液漏斗、烧杯、铁架台等①萃取剂的选取:与原溶剂不反应、不互溶;与溶质不反应;溶质在其中的溶解度要大大与在原溶剂的溶解度;两溶剂密度差别要大。②萃取后一般要进行分液;③萃取后得到的仍是溶液,一般是再通过分馏的方法进一步的分离。蒸馏利用沸点的不同分离互溶液体的混合物蒸馏烧瓶、水冷凝管、牛角管、锥形瓶、温度计、铁架台、石棉网、酒精灯等①温度计水银球的位应在蒸馏烧瓶的支管开口处;②水冷凝管的水流向是逆流;③一般要加碎瓷片防止爆沸;④实验中烧瓶不可蒸干。用心爱心专心二、化学实验基本操作2.常见物质离子的检验常见离子的检验列表如下:离子选用试剂主要实验现象有关离子方程式Cl-AgNO3溶液和稀HNO3有白色沉淀Ag++Cl-==AgCl↓Br-AgNO3溶液和稀HNO3有浅黄色沉淀Ag++Br-==AgBr↓I-AgNO3溶液和稀HNO3有黄色沉淀Ag++I-==AgI↓SO42-稀HCl和BaCl2溶液先加稀HCl,再加BaCl2溶液有白色沉淀Ba2++SO42-==BaSO4↓SO32-稀HCl和品红溶液有刺激性的气体产生并使品红褪色SO32-+2H+==SO2↑+H2OS2-稀HCl和Pb(NO3)2溶液或CuSO4溶液等有臭鸡蛋味气体,气体通溶液有黑色沉淀S2-+2H+==H2S↑S2-+Pb2+==PbS↓Cu2++S2-==CuS↓NO3-Cu和浓H2SO4,加热有红棕色刺激性气体Cu+4H++2NO3-△Cu2++2NO2↑+2H2OCO32-稀HCl和澄清石灰水有能使石灰水变浑浊的气体CO32-+2H+==H2O+CO2↑CO2+Ca(OH)2==CaCO3↓+H2OBa2+硫酸或可溶性的硫酸盐有白色沉淀Ba2++SO42-==BaSO4↓Mg2+NaOH溶液有白色沉淀,NaOH过量沉淀不溶解Mg2++2OH-==Mg(OH)2↓Al3+NaOH溶液和氨水加氨水至过量有白色絮状沉淀,再加NaOH溶液沉淀溶解Al3++3OH-==Al(OH)3↓Al(OH)3+OH-==AlO2-+2H2OFe3+NaOH溶液或KSCN溶液有红褐色沉淀或溶液呈血红色Fe3++3OH-==Fe(OH)3↓(红褐色)Fe3++SCN-==[Fe(SCN)]2+(血红色)用心爱心专心Fe2+①NaOH溶液②氯水和KSCN溶液①生成白色沉淀,在空气中迅速变为灰绿色,最后变为红褐色沉淀。②先加KSCN溶液无明显现象,再加氯水溶液呈血红色。①Fe2++2OH-==Fe(OH)2(白色沉淀)↓,4Fe(OH)2+O2+2H2O==4Fe(OH)3。②2Fe2++Cl2==2Fe3++2Cl-,Fe3++SCN-==[Fe(SCN)]2+或Fe3++3SCN-==Fe(SCN)3。Ag+稀HCl或可溶性的氯化物,稀HNO3有白色沉淀Ag++Cl-==AgCl↓NH4+NaOH溶液加热用湿润的红色石蕊试纸检验产生的气体,变蓝NH4++OH-△NH3↑+H2ONa+做焰色反应火焰呈黄色K+做焰色反应透过蓝色钴玻璃观察火焰是紫色3.物质的量浓度溶液的配制(1)主要仪器:容量瓶、烧杯、玻璃棒、胶头滴管、天平或量筒或滴定管等。容量瓶使用时应注意:①使用前要检漏;②有四个不准:不允许加热、不允许物质的溶解或稀释、不允许物质间的反应、不允许储存药品;③容量瓶上标有:容量规格、使用温度和刻度线;④容量瓶检漏的方法:将容量瓶注入一定量的水,塞紧塞子,一手抵住塞子,一手托住瓶底,将瓶颠倒,不漏水,再将塞子旋转180度,再重复操作一次,如不漏即可。(2)配制步骤:计算、量取或称量、稀释或溶解、冷却移液、洗涤移液、定容、摇匀、装瓶贴标签。定容时应:加水离刻度线1-2cm时,改用胶头滴管加水至刻度线。(3)误差分析:(...