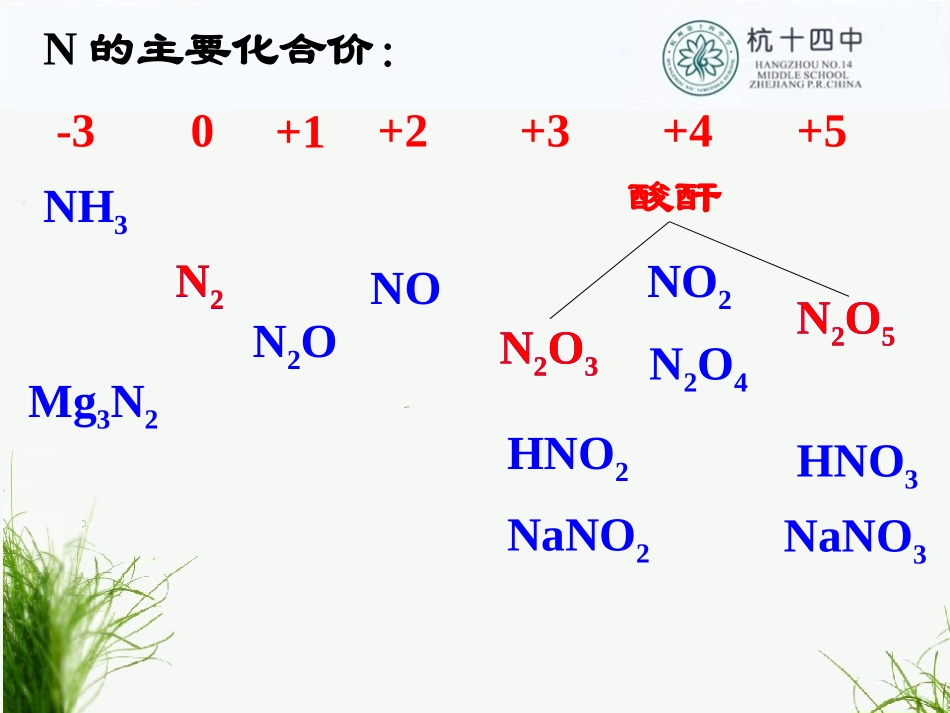
第二单元生产生活中的含氮化合物-30+1+2+3+4+5N的主要化合价:NH3Mg3N2N2NONO2N2O4HNO3N2O5NaNO3N2ON2O3N2HNO2NaNO2N2O3N2O5酸酐一、氮的固定:游离态氮转化成化合态工业合成氨(人工固氮)豆科植物的根瘤菌把N2转变为NH3(自然固氮)闪电时N2和O2直接化合(自然固氮)二、N2的化学性质:化学性质很稳定N2+O22NO放电N2+3H22NH3催化剂高温高压N2+3MgMg3N2点燃想一想:如何得到纯净的N2?分离液态空气想一想:实验室中如何除去N2中的O2?气体通过灼热的铜网三、氮的氧化物:1、NO:无色气体,难溶于水,有毒,能跟血红蛋白作用,而引起中毒。2NO+O2=2NO2NO遇空气即变红棕色--检验、鉴定NO气体2、NO2:红棕色、有刺激性气味;有毒;易溶于水,与水能反应3NO2+H2O2HNO3+NO氧化剂、还原剂(12)2e-想一想:如何理解谚语“雷雨发庄稼”?N2NONO2HNO3氮肥3、氮氧化物(NOX)对环境的污染•来源:氮肥的生产、金属的冶炼、汽车的使用等•危害:①形成硝酸型酸雨②形成光化学烟雾NO2+O2→O3O3+CxHy→有毒烟雾③破坏臭氧层(形成臭氧空洞)氮的氧化物、氟氯烃(氟利昂)等。光想一想:NO2和Br2蒸气均为红棕色,该如何区别?1、通入水中2、通入硝酸银溶液中能否利用湿润的淀粉-KI试纸?不能。均能氧化I-到I2,使淀粉变蓝。思考:如果将一支充满NO2的试管倒立于水槽中你会观察到什么现象?练习:将充满NO和NO2的混合气体45mL的试管,倒立于水中,一段时间后,气体的体积为35mL,原混合气体中,NO和NO2的体积比为A.2:1B.2:7C.7:2D.9:7A试管内水面上升到2/3处试管内气体呈无色若是NO2或NO与O2的混合气体?=4︰1,>4︰1,<4︰1,(1)NO2和O2的混合气体溶于水:3NO2+H2O2HNO3+NO2NO+O22NO2恰好完全反应NO2过量,剩余气体为NOO2过量,剩余气体为O2可得:4NO2+O2+2H2O=4HNO3V(NO2)V(O2)=4︰3,>4︰3,<4︰3,(2)NO和O2的混合气体溶于水:3NO2+H2O2HNO3+NO2NO+O22NO2恰好完全反应NO过量,剩余气体为NOO2过量,剩余气体为O2可得:4NO+3O2+2H2O=4HNO3V(NO)V(O2)下列各组气体:(1)NO2+NO(2)NO2+O2(3)HCl+N2(4)Cl2+SO2等体积混合,分别通入体积相同的试管并立即倒立在足量的水中,足够长时间后,试管内水面上升高度分别为h1、h2、h3、h4,下列高度关系判断正确的是()A:h2>h3>h1>h4B:h3>h2>h1>h4C:h4>h2>h3>h1D:h1>h2>h3>h4C三、氮肥的生产和使用1800年未使用化肥每公顷耕地生产0.73吨粮食1978年使用化肥每公顷耕地生产4.63吨粮食如果不施化肥,中国只能养活2亿多人口,剩下11亿人就没饭吃。氮肥的种类:铵态化肥都来源于NH3硝态化肥:硝酸盐尿素(CO(NH2)2)NH4ClNH4HCO3(NH4)2SO4铵态化肥哈伯波施分别获得1918年和1932年诺贝尔化学奖N2+3H22NH3高温、高压催化剂1、工业制NH3方法(合成氨)无色有刺激性气味的气体,密度比空气小,易液化;液态氨汽化时要吸收周围的热量,使周围的空气迅速变冷(常用作致冷剂)。极易溶于水(体积比1∶700)2、氨气的物理性质喷泉实验烧杯中的水沿着导管喷入烧瓶,形成美丽的喷泉,酚酞溶液变成红色。问题1、喷泉形成的原因?瓶中氨气溶于胶头滴管挤入的水中瓶中气压下降小于外界气压烧杯中的水被大气压压入烧瓶形成喷泉氨气极易溶于水(1︰700)关键:烧瓶内外形成明显的气压差引发喷泉的操作是?引发喷泉的操作是?打开止水夹,打开止水夹,把胶头滴管中的水挤入烧瓶。把胶头滴管中的水挤入烧瓶。打开止水夹,用热毛巾将烧瓶打开止水夹,用热毛巾将烧瓶捂热,捂热,NHNH33受热膨胀,与水接受热膨胀,与水接触,即发生喷泉。触,即发生喷泉。如何引发喷泉?如何引发喷泉?问题2:溶液为什么变红?①NH3的水溶液(氨水)显碱性思考:氨水中含有的微粒有哪些?NHNH33++HH22ONHONH33·H·H22OO大部分NHNH44++++OHOH--小部分分子:H2ONH3NHNH33·H·H22OO离子:NHNH44++、、OHOH--、极少量、极少量HH++3、氨气的化学性质实验2:现象:湿润的红色石蕊试纸变成蓝色。结论:氨水易挥发,氨气的水溶液具有碱性。实验3:现象:烧杯中出现白烟结论:浓氨水、浓盐酸具有挥发性,NH3会与HCl反应生成NH4Cl固体小颗粒。NH3+HCl=NH4Cl②②NH3可以与酸反应生成铵盐NH3+HNO...