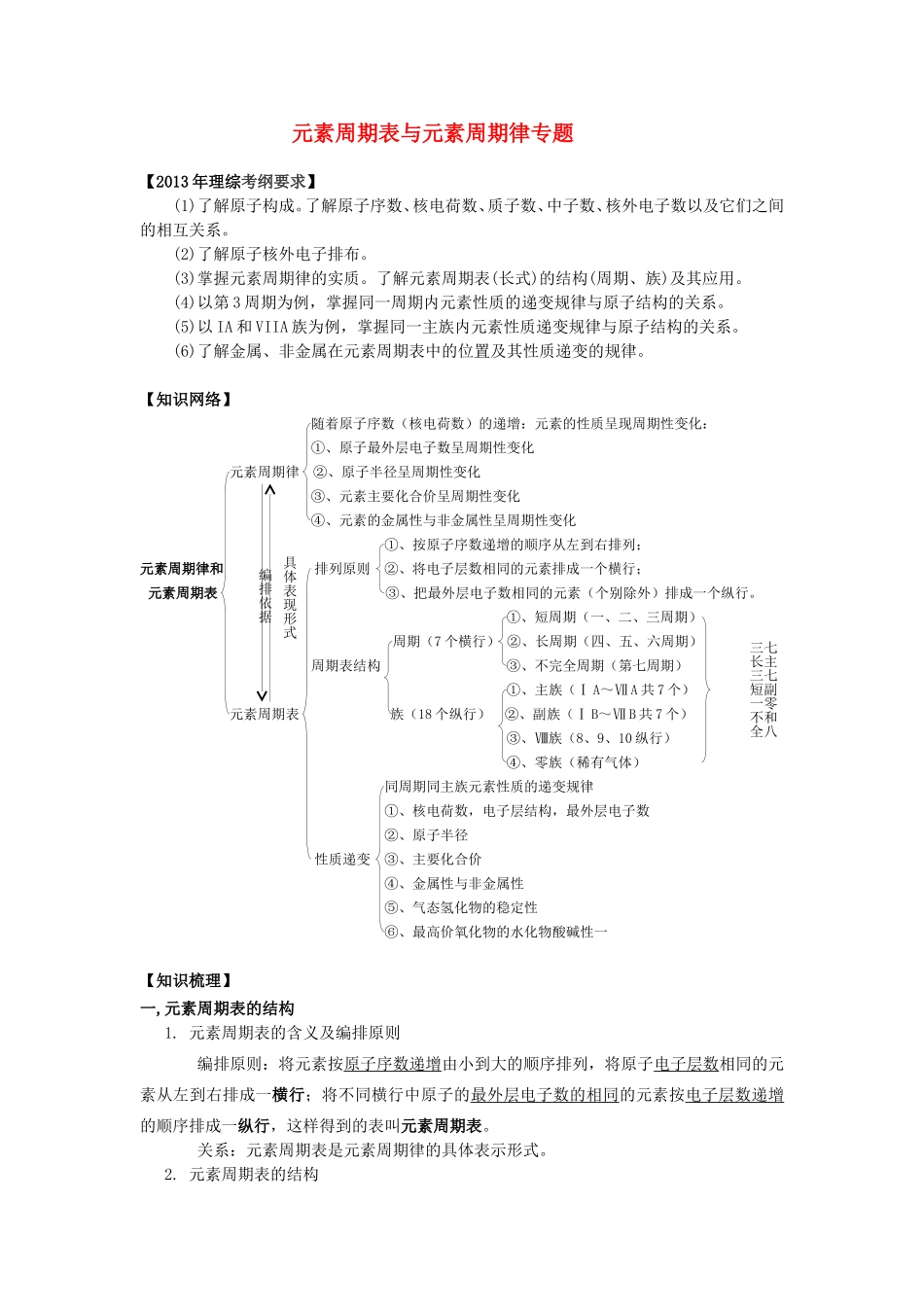
元素周期表与元素周期律专题【2013年理综考纲要求】(1)了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。(2)了解原子核外电子排布。(3)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。(4)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。(5)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。(6)了解金属、非金属在元素周期表中的位置及其性质递变的规律。【知识网络】随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化:①、原子最外层电子数呈周期性变化元素周期律②、原子半径呈周期性变化③、元素主要化合价呈周期性变化④、元素的金属性与非金属性呈周期性变化①、按原子序数递增的顺序从左到右排列;元素周期律和排列原则②、将电子层数相同的元素排成一个横行;元素周期表③、把最外层电子数相同的元素(个别除外)排成一个纵行。①、短周期(一、二、三周期)周期(7个横行)②、长周期(四、五、六周期)周期表结构③、不完全周期(第七周期)①、主族(ⅠA~ⅦA共7个)元素周期表族(18个纵行)②、副族(ⅠB~ⅦB共7个)③、Ⅷ族(8、9、10纵行)④、零族(稀有气体)同周期同主族元素性质的递变规律①、核电荷数,电子层结构,最外层电子数②、原子半径性质递变③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性一【知识梳理】一,元素周期表的结构1.元素周期表的含义及编排原则编排原则:将元素按原子序数递增由小到大的顺序排列,将原子电子层数相同的元素从左到右排成一横行;将不同横行中原子的最外层电子数的相同的元素按电子层数递增的顺序排成一纵行,这样得到的表叫元素周期表。关系:元素周期表是元素周期律的具体表示形式。2.元素周期表的结构编排依据具体表现形式七主七副零和八三长三短一不全(1)周期(2)族二,元素周期律(1)随原子序数的递增,原子核外电子排布的变化规律:原子最外层电子数呈从1递增到2或8的周期性变化。(2)随原子序数递增,原子半径变化的规律:原子半径呈从大到小的周期性变化。(3)随原子序数递增,元素主要化合价变化的规律:元素的最高化合价呈从+1→+7(O、F例外),负价从无到有,从-4→-1、0的周期性变化。☆特别注意:元素周期律的内涵和实质三,元素周期表与元素周期律知识整合:1,重要规律:①周期的序数=电子层数②主族的序数=原子最外层电子数③非金属元素最高价和最底价的绝对值之和等于8④原子序数=质子数=核电荷数副族和Ⅷ族最外层只有1~2个电子;最外层电子数是次外层电子数的2倍或3倍的元素,位于2周期;次外层电子数是8的元素位于3周期和第IA、IIA族(其中H、Li、Be除外)2,重点归纳:(1)原子半径、离子半径的大小判断方法:电子层数:相同条件下,电子层越多,半径越大。判断的依据核电荷数相同条件下,核电荷数越多,半径越小。最外层电子数相同条件下,最外层电子数越多,半径越大。微粒半径的比较1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)如:Na>Mg>Al>Si>P>S>Cl.2、同主族元素的原子半径随核电荷数的增大而增大。如:LiNa+>Mg2+>Al3+5、同一元素不同价态的微粒半径,价态越高离子半径越小。如Fe>Fe2+>Fe3+(2)元素的金属性和非金属性强弱的判断:内涵元素性质随着元素原子序数的递增而呈周期性变化。实质元素原子结构的周期性变化决定了元素性质周期性变化。知识网络:①与水反应置换氢的难易②最高价氧化物的水化物碱性强弱金属性强弱③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)④互相置换反应依据:⑤原电池反应中正负极①与H2化合的难易及氢化物的稳定性元素的非金属性强弱②最高价氧化物的水化物酸性强弱金属性或非金属③单质的氧化性或离子的还原性性强弱的判断④互相置换反应①、同周期元素的金属性,随荷电荷数的增加而减小,如:Na>Mg>A...