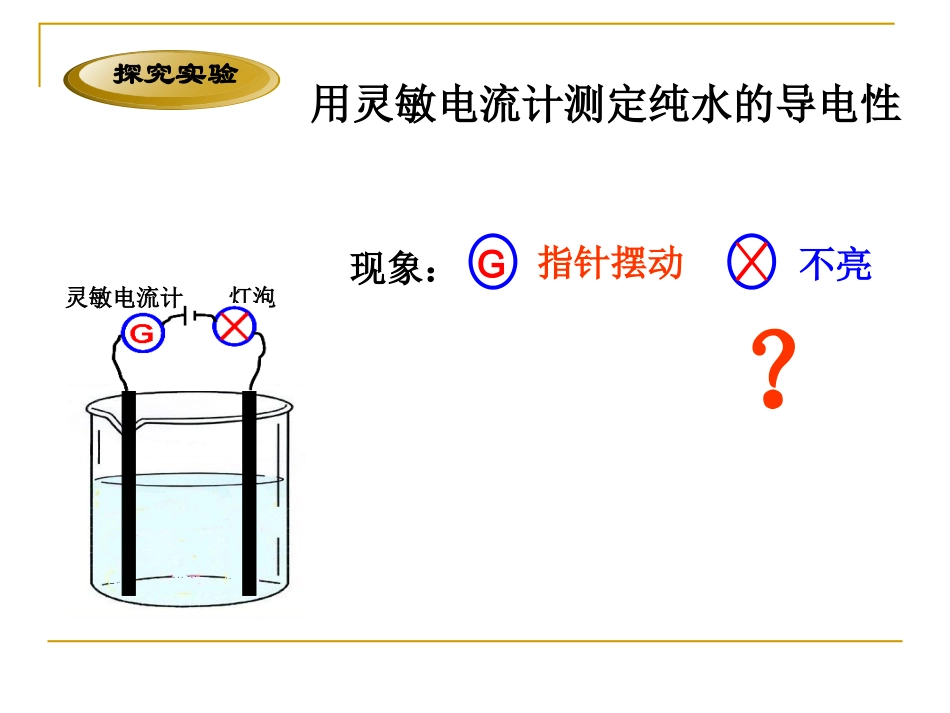
第1课时1.对①0.1mol·L-1CH3COOH0.01mol·L②-1的CH3COOH进行下列比较(填序号):电离度[H+]酸性①<②①>②①>②2.书写下列电解质电离方程式与电离平衡常数表达式NH3·H2OCH3COOHH2O探究实验用灵敏电流计测定纯水的导电性G现象:指针摆动不亮灯泡灵敏电流计?简写为:H2OH++OH-(水电离出的H+、OH-浓度相等)一、水的电离H2O+H2OH3O++OH-水是极弱的电解质水合氢离子25℃时,1L水中只有10-7molH2O分子发生电离K.=c(H+).c(OH-)c(H2O)Kw=c(H+).c(OH-)其中常数K与常数c(H2O)的积记为Kw,称为水的离子积常数,简称水的为离子积。H2OH++OH-1、水的离子积常数K电离=c(H+)×c(OH-)c(H2O)KW=c(H+)·c(OH-)=1×10-14温度KW=K电离c(H2O)常温下(25℃)时,水电离出来的c(H+)=c(OH-)=10-7mol/LKw100℃50℃25℃20℃0℃温度1.34×10-156.81×10-151.01×10-145.47×10-145.5×10-13Kw会受哪些因素的影响?WHY?升高温度:平衡向______移动c(H+)_______,c(OH-)________,Kw——————右增大H2OH++OH-电离吸热注意:(1)水的离子积只随温度的改变而改变。(2)Kw不仅适用于纯水,也适用于酸碱盐的稀溶液。KW=c(H+)·c(OH-)增大增大H2OH++OH-常温下对纯水进行下列操作:加NaOH加HCl加热Kwc(H+)c(OH-)浓度大小关系c(OH-)c(H+)水的电离平衡移动方向酸碱性条件增大c(H+)>c(OH-)c(H+)