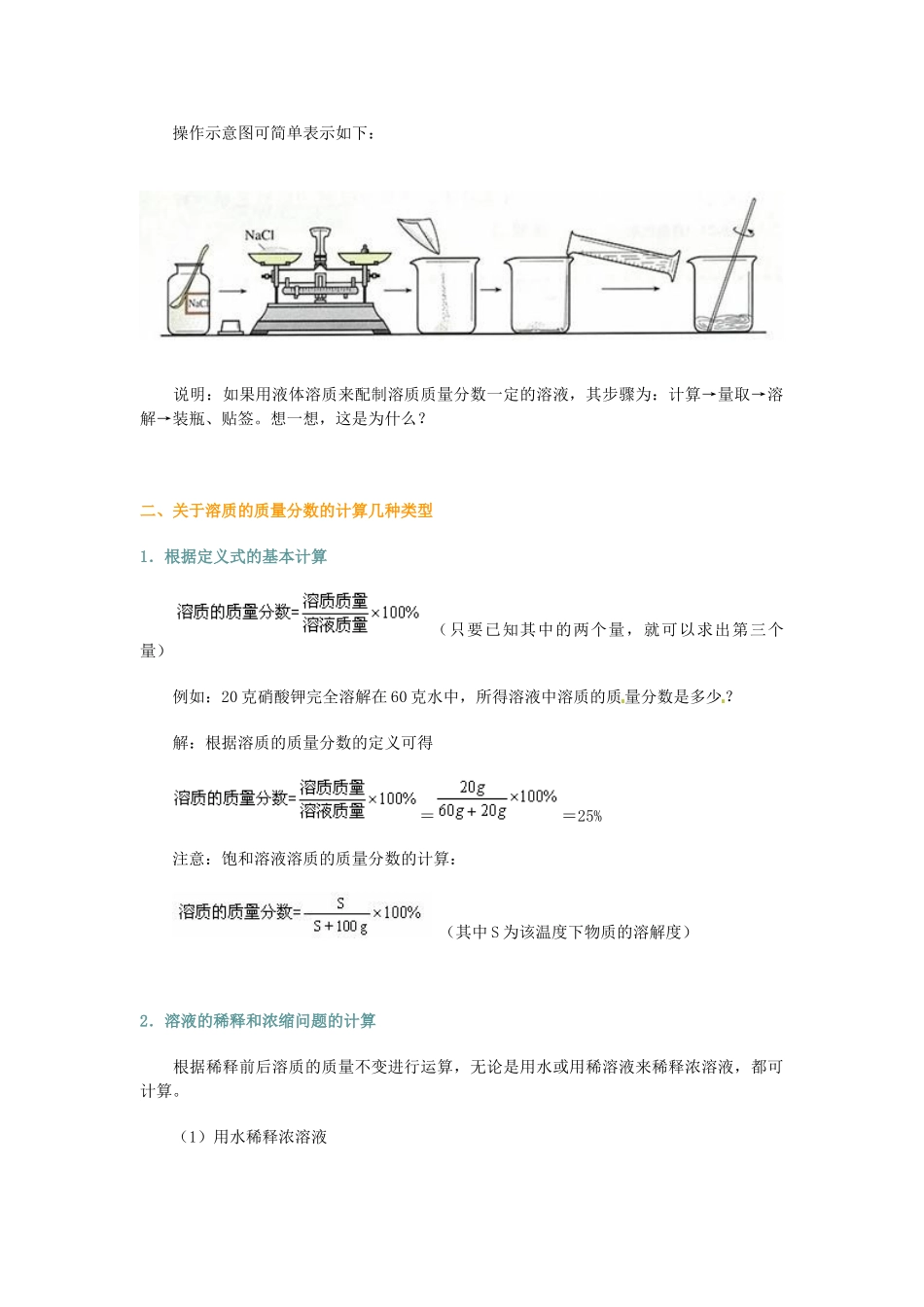
溶质的质量分数【主要内容】溶液中溶质的质量分数及其计算【知识要点】一、溶质的质量分数溶液的浓稀、有色溶液的颜色都可以粗略的表示一定量的溶液中含有溶质的多少,溶液中溶质的质量分数可以准确地表示一定量的溶液中含有溶质的多少。1.定义:溶液中溶质的质量分数是溶质质量与溶液质量之比。数学表达式:特点:无单位、是个比值、一般不受温度的影响等。饱和溶液溶质的质量分数的计算:(其中S为该温度下物质的溶解度)2.配制溶质质量分数一定的溶液以配制100g溶质质量分数为5%的氯化钠溶液为例分析:(1)计算:计算配制100g溶质质量分数为5%的氯化钠溶液所需氯化钠和水的质量。(2)称量:用托盘天平称量所需的氯化钠。(3)量取:用量筒量取所需的水(水的密度近似看作1g/cm3)。(4)溶解:将量好的水倒入盛有称量好氯化钠的烧杯中,用玻璃棒搅拌,使氯化钠溶解。(5)装瓶、贴签:把配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签,备用。操作示意图可简单表示如下:说明:如果用液体溶质来配制溶质质量分数一定的溶液,其步骤为:计算→量取→溶解→装瓶、贴签。想一想,这是为什么?二、关于溶质的质量分数的计算几种类型1.根据定义式的基本计算(只要已知其中的两个量,就可以求出第三个量)例如:20克硝酸钾完全溶解在60克水中,所得溶液中溶质的质量分数是多少?解:根据溶质的质量分数的定义可得==25%注意:饱和溶液溶质的质量分数的计算:(其中S为该温度下物质的溶解度)2.溶液的稀释和浓缩问题的计算根据稀释前后溶质的质量不变进行运算,无论是用水或用稀溶液来稀释浓溶液,都可计算。(1)用水稀释浓溶液设稀释前浓溶液的质量为m,其溶质的质量分数为a%,稀释时加入水的质量为n,稀释后溶质的质量分数为b%。则可得m×a%=(m+n)×b%(2)用稀溶液稀释浓溶液设浓溶液的质量为A,其溶质的质量分数为a%,稀溶液的质量为B,其溶质的质量分数为b%,两溶液混合后所得溶液溶质的质量分数为c%。则可得A×a%+B×b%=(A+B)×c%(3)蒸发水进行浓缩设浓缩前稀溶液的质量为m,其溶质的质量分数为a%,蒸发水的质量为n,浓缩后溶质的质量分数为b%。则可得m×a%=(m-n)×b%说明:如果采用加入溶质的方法使溶液中溶质的质量分数增大,那么可以根据:(1)后来溶液中溶质的量=加入溶质前溶液中溶质的质量+加入溶质的质量;(2)溶剂的质量不变进行计算。设加入溶质前稀溶液的质量为m,其溶质的质量分数为a%,加入溶质的质量为n,加入溶质后溶质的质量分数为b%。则可得m×a%+n=(m+n)×b%或者m×(1-a%)=(m+n)×(1-b%)3.溶质的质量分数和化学方程式的综合计算。例如:将200g硫酸溶液恰好跟一定量的锌反应,生成氢气0.4g,试求:(1)参加反应的锌的质量;(2)硫酸溶液溶质的质量分数;(3)将此硫酸溶液100g稀释成5℅的硫酸溶液,需加水多少克?(4)反应后生成的溶液中溶质的质量分数。【分析】此题比较综合的考查了“根据化学方程式进行计算”、“溶液中溶质质量分数的计算”、“溶液的稀释问题”等知识点。设参加反应的锌的质量为x,硫酸溶液中溶质的质量为y,生成硫酸锌的质量为z,根据化学方程式计算出相关的量:(1)参加反应的锌的质量为13g(2)200g硫酸溶液中溶质的质量分数为:ω(H2SO4)=(3)设需要加入水的质量为a,根据稀释前后溶质的质量不变可以列式:100g×9.8%=(100g+a)×5%∴a=96g(4)反应后得到的溶液为ZnSO4溶液,首先溶质ZnSO4的质量为32.2g而溶液的质量的计算可以采用两种方法:方法一(采用质量守恒):m(溶液)=(200g+13g)―0.4g=212.6g方法二(通过计算溶剂的质量进行计算):m(溶液)=m(溶质)+m(溶剂)=32.2g+(200g―19.6g)=212.6g则溶液中溶质的质量分数为:ω(H2SO4)=答:参加反应的锌的质量为13g;硫酸溶液的溶质质量分数为9.8%;需要加入水的质量为96g;最后所得溶液的溶质的质量分数为15.1%【例题解析】1.日常生活中我们要科学地节约用水。现有一件刚用洗涤剂洗过的衣服,“拧干”后湿衣服上残留的溶液为100g,其中洗涤剂的质量分数为1%,则湿衣服上残留的洗涤剂质量为________g。现用5700g清水对这件衣服进行漂洗,有以...