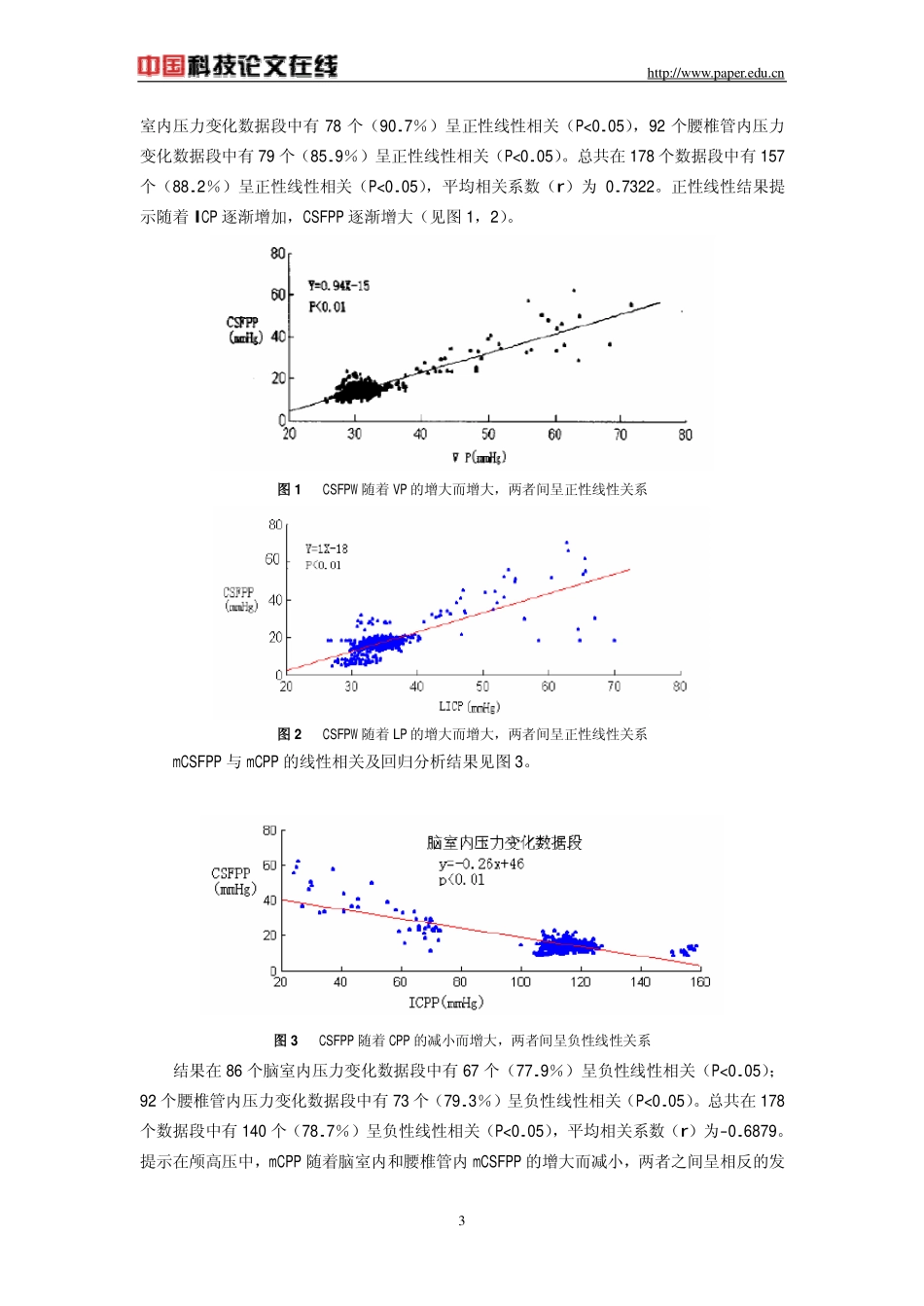
http://www.paper.edu.cn1颅高压时脑脊液脉动压与颅内灌注压相互关系的实验研究袁晖蒋雨平1吴国强*许世雄**刘玉峰**复旦大学附属华山医院神经科(200040)*复旦大学医学院医学工程教研室**复旦大学力学工程系摘要目的:研究颅高压中脑脊液脉动压与颅内灌注压的相互变化关系。方法:14条狗安置硬膜外球囊并注液制成颅高压模型。通过改变球囊内液体量改变颅高压程度和颅内容积。通过压力传感器持续记录脑室内压力、腰椎管内压力及体动脉压。结果:随着颅内压的持续增高,颅内灌注压逐渐下降,脑脊液脉动压相应增高。脑脊液脉动压与颅内压的变化趋势呈现正性线性关系,而与颅内灌注压的变化趋势呈现负性线性关系。结论:在实验性颅高压中,脑脊液脉动压随着颅内灌注压的下降而增大,两者间呈现负性线性关系。在脑血管自动调节机制受损的情况下,脑脊液脉动压的变化可能提供脑血流量改变的信息。关键祠颅高压脑脊液脉动压脑灌注压脑脊液脉动压(cerebrospinalfluidpulsepressure,CSFPP)是指在颅内压(intracranialpressure,ICP)的基础上随着心脏波动的周期而出现的上下压力波动[1]。研究发现持续高颅压状态下颅内灌注压(intracranialperfusionpressure,ICPP)下降,CSFPP却增大[2],两者之间可能存在着一定的相互变化关系。本文即以狗为研究对象,着重研究在颅高压状态下CSFPP和ICPP的相互变化关系。1材料与方法1.1材料1.1.1实验动物健康杂种狗14条,雌雄不拘,体重9~15kg,平均12.01±1.43kg。所有动物均由复旦大学医学院动物房提供。1.1.2实验仪器采用SMUP-PC型生物信号处理系统(复旦大学医学院生理学教研室研制)同步进行ICP、体动脉压(systematicarterialpressure,SAP)、心率(heartrate,HR)及心电活动的记录。1.2方法1.2.1颅高压模型的建立以及加压球囊和颅内压传感器的置入实验动物均静推乌氯合剂(乌拉坦700mg/kg,氯醛糖45mg/kg),进行全身麻醉。行气管切开后,即静推肌松剂三碘季本课题为教育部高等学校博士点学科专项科研基金项目(2000026534)【作者简介】袁晖,男,(1970-),华山医院神经病学博士毕业,现就职于同济大学附属铁路医院http://www.paper.edu.cn2胺酚[1mg/(kg•h)]以抑制呼吸,并立即给予呼吸机辅助呼吸,呼吸模式设定为容量控制型(潮气量12ml/kg,呼吸频率24次/min)。进行股动脉插管,接压力传感器(P-300型)记录SAP。在颅顶中线旁开1~1.5cm,冠状缝前0.5cm处双侧钻孔,将自然容量为2ml的乳胶球囊置入一侧硬膜外腔,以便注液后模拟颅内急性占位病变,造成颅高压;另一侧钻孔,留置脑室引流管,待脑脊液逐渐充满塑料引流管时,接到压力传感器以测定脑室内压(VP)。两侧颅骨钻孔均用骨水泥封闭,保证测压的可靠性。所有动物均行腰穿并置管,畅通后固定,接压力传感器记录腰椎管内CSF压力(LP)变化。手术完毕后保持动物于仰卧位并固定于操作台上,尽量使脑室和腰椎管保持在同一水平。操作完毕后,所有动物均持续静脉滴注生理盐水并行膀胱造漏,以保证在下面的实验过程中有稳定的尿量排出。1.2.2实验操作过程及数据记录对每一动物首先进行VP、LP、SAP、HR、CSFPP和心电活动的基础数据记录,然后进行第一阶段颅内压升高实验。以快速推注的方式将1ml生理盐水注入硬膜外球囊,造成急性颅内高压;并持续记录VP、LP和CSFPP的变化过程10分钟。然后再次快速推注1ml生理盐水于硬膜外球囊,记录10分钟。依次类推,直至VP和/或LP100mmHg(mmHg=0.133kPa)时即排空球囊内液体,本过程为颅内压升高实验第一阶段(阶段1)。静息一段时间,待实验动物的VP、LP、CSFPP和心电活动的数据基本恢复到第一次球囊注水前的基础数据且生命征保持稳定时(本过程大约1小时左右),再次依次向球囊内快速推注1ml生理盐水,每次记录10分钟,方法同前,直到出现VP和/或LP达到或超过100mmHg时,最终排空球囊。本过程为颅压升高实验第二阶段(阶段2)。1.2.3实验数据分析和统计学处理将每次推注生理盐水后经生物信号处理系统记录下各种原始数据利用MFLab200功能学科实验软件包输出为文本文件。然后采用Matlab软件分析检测每段文本数据,以每次心搏为采集点,记录下每次心搏时的平均VP...