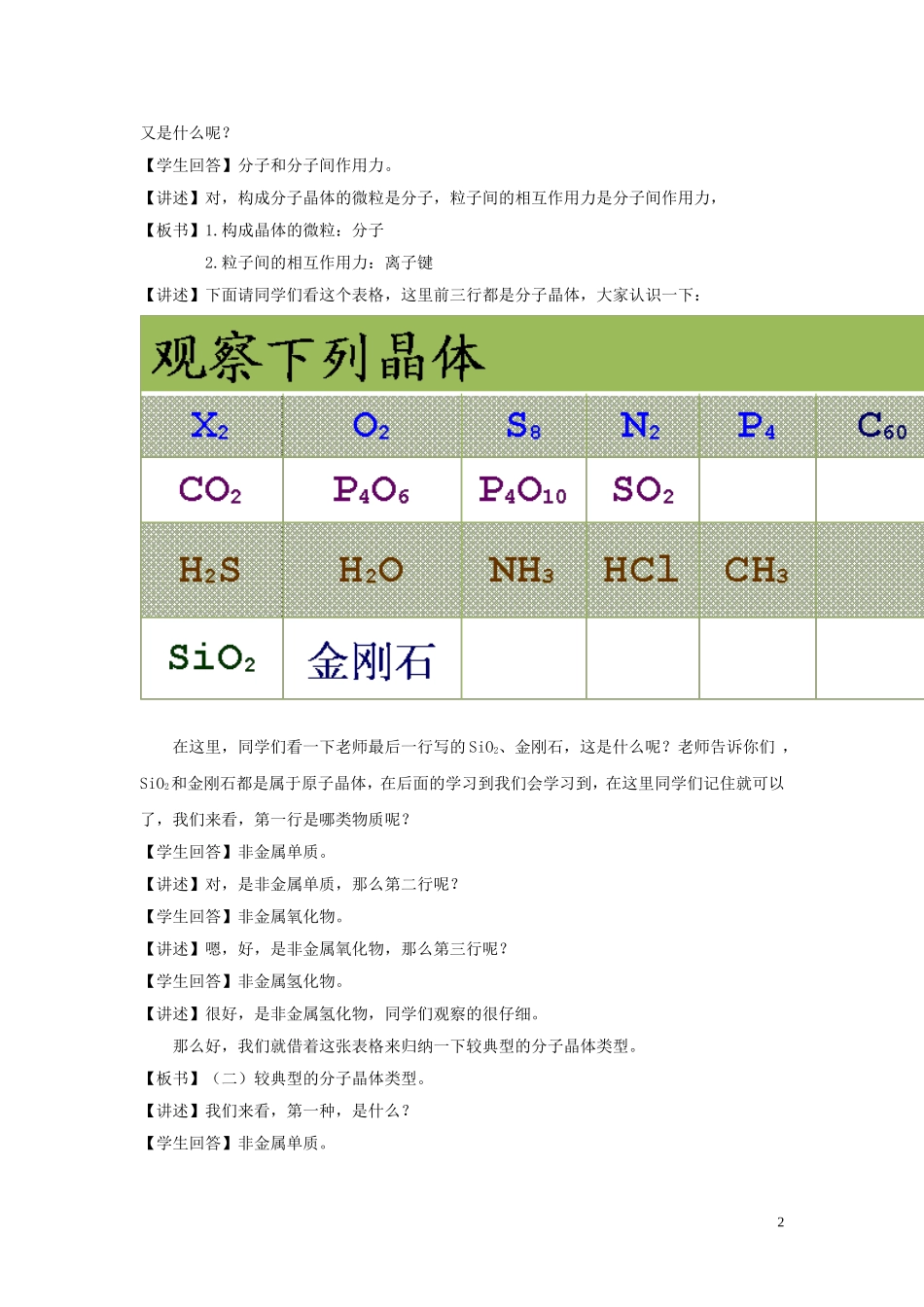
§3.2分子晶体和原子晶体——分子晶体【导入】同学们大家好,上节课我们学习了离子晶体,回顾一下,什么是离子晶体?它又包含了哪些物质?【学生回答】所谓离子晶体是指阴、阳离子通过离子键结合所形成的晶体,离子化合物为固态时均属于离子晶体,如大部分盐、碱、金属氧化物属于离子化合物。【回应】对,同学们说得很好,所谓离子晶体是指阴、阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。【讲述】下面同学们来看这张表格,上节课我们分别从结构特点和性质特点讨论了离子晶体填写了这张表格,下面我们回顾一下:晶体类型离子晶体结构构成晶体的微粒离子粒子间的相互作用力离子键性质硬度较大熔沸点较高导电性导电那么请同学们对照着这张表格想一想,冰、干冰、碘晶体是离子晶体吗?【学生回答】不是【讲述】那是什么晶体呢?构成它的粒子是什么呢?这些粒子又是通过什么作用结合而成的呢?好,今天我们来学习一种新的晶体——分子晶体,在学过后我们就可以解决这些问题,同学们请打开书看一下65-66页的内容。【板书】§3.2分子晶体和原子晶体一、分子晶体【讲述】同学们,什么是分子晶体呢?【学生应答】只含有分子的晶体称为分子晶体。【讲述】对,只含有分子的晶体称为分子晶体,我们又可以说分子间以分子间作用力相结合所形成的晶体称之为分子晶体。【板书】(一)定义:分子间以分子间作用力相结合所形成的晶体。【讲述】同学们,从定义中我们可以知道,构成分子晶体的微粒是什么,粒子间的相互作用力1又是什么呢?【学生回答】分子和分子间作用力。【讲述】对,构成分子晶体的微粒是分子,粒子间的相互作用力是分子间作用力,【板书】1.构成晶体的微粒:分子2.粒子间的相互作用力:离子键【讲述】下面请同学们看这个表格,这里前三行都是分子晶体,大家认识一下:在这里,同学们看一下老师最后一行写的SiO2、金刚石,这是什么呢?老师告诉你们,SiO2和金刚石都是属于原子晶体,在后面的学习到我们会学习到,在这里同学们记住就可以了,我们来看,第一行是哪类物质呢?【学生回答】非金属单质。【讲述】对,是非金属单质,那么第二行呢?【学生回答】非金属氧化物。【讲述】嗯,好,是非金属氧化物,那么第三行呢?【学生回答】非金属氢化物。【讲述】很好,是非金属氢化物,同学们观察的很仔细。那么好,我们就借着这张表格来归纳一下较典型的分子晶体类型。【板书】(二)较典型的分子晶体类型。【讲述】我们来看,第一种,是什么?【学生回答】非金属单质。2【讲述】对,非金属单质,那么是所有的非金属单质吗?我们说金刚石是不是单质啊【学生回答】是【讲述】对,金刚石是单质,所以不能说是所有的非金属单质,而是部分非金属单质。【板书】1.部分非金属单质【讲述】接下来我们来看第二行,第二行是什么?【学生回答】非金属氧化物。【讲述】是,那么是全部的非金属氧化物吗?【学生回答】不是,SiO2不是分子晶体【讲述】对,不是所有的非金属氧化物,而是部分非金属氧化物。【板书】2.部分非金属氧化物。【讲述】接下来看最后一行,最后还有什么?【学生回答】非金属氢化物。【讲述】是,我们说所有的非金属氢化物。【板书】3.所有的非金属氢化物。【讲述】在这里,我们说还有几乎所有的酸和绝大多数有机物的晶体。【板书】4.几乎所有的酸。5.绝大多数有机物的晶体。【讲述】好,这就是我们所学的较典型的分子晶体,下面我们来回顾一下旧知识:分子间作用力和氢键。【板书】分子间作用力和氢键【讲述】上节课我让同学们把必修2教材带来,下面同学们把书打开到22页,我们来看一下科学视野。看第一段第二句话,分子间存在着一种把分子聚集在一起的作用力叫做分子间作用力,也叫范徳华力。那么,分子间作用力对物质的性质有怎么样的影响?同学们来看一下第二段话,一般来说,对与组成和结构相似的物质,相对分子量越大分子间作用力越大,物质的熔沸点也越高。【讲述】但是有些氢化物的熔点和沸点的递变却与此不完全符合,如:NH3,H2O和HF的沸点就出现反常。这又是为什么呢?【学生回答】因为有氢键。【讲述】对,因为有氢键的存在,这里同学们看这张挂图,...