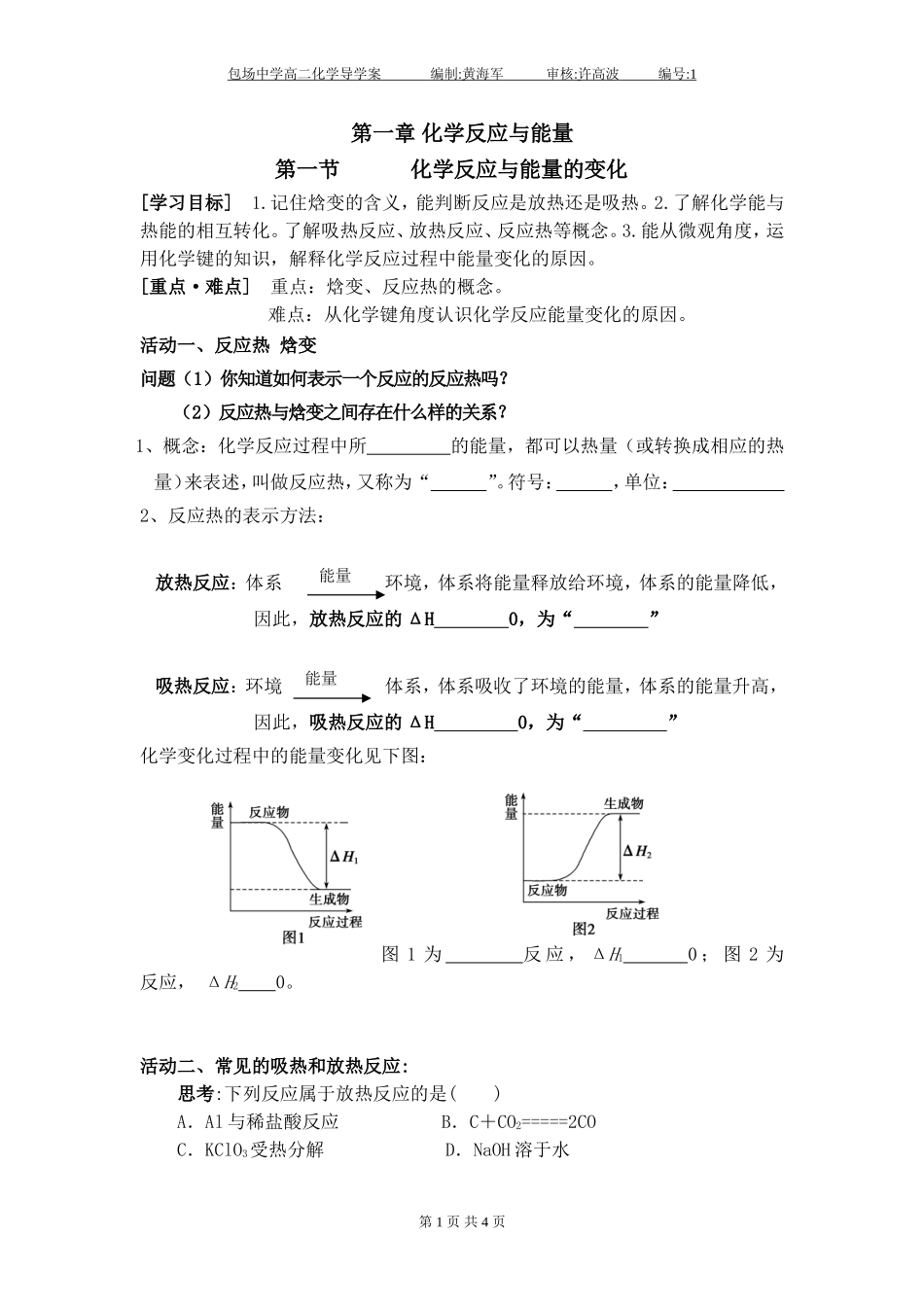
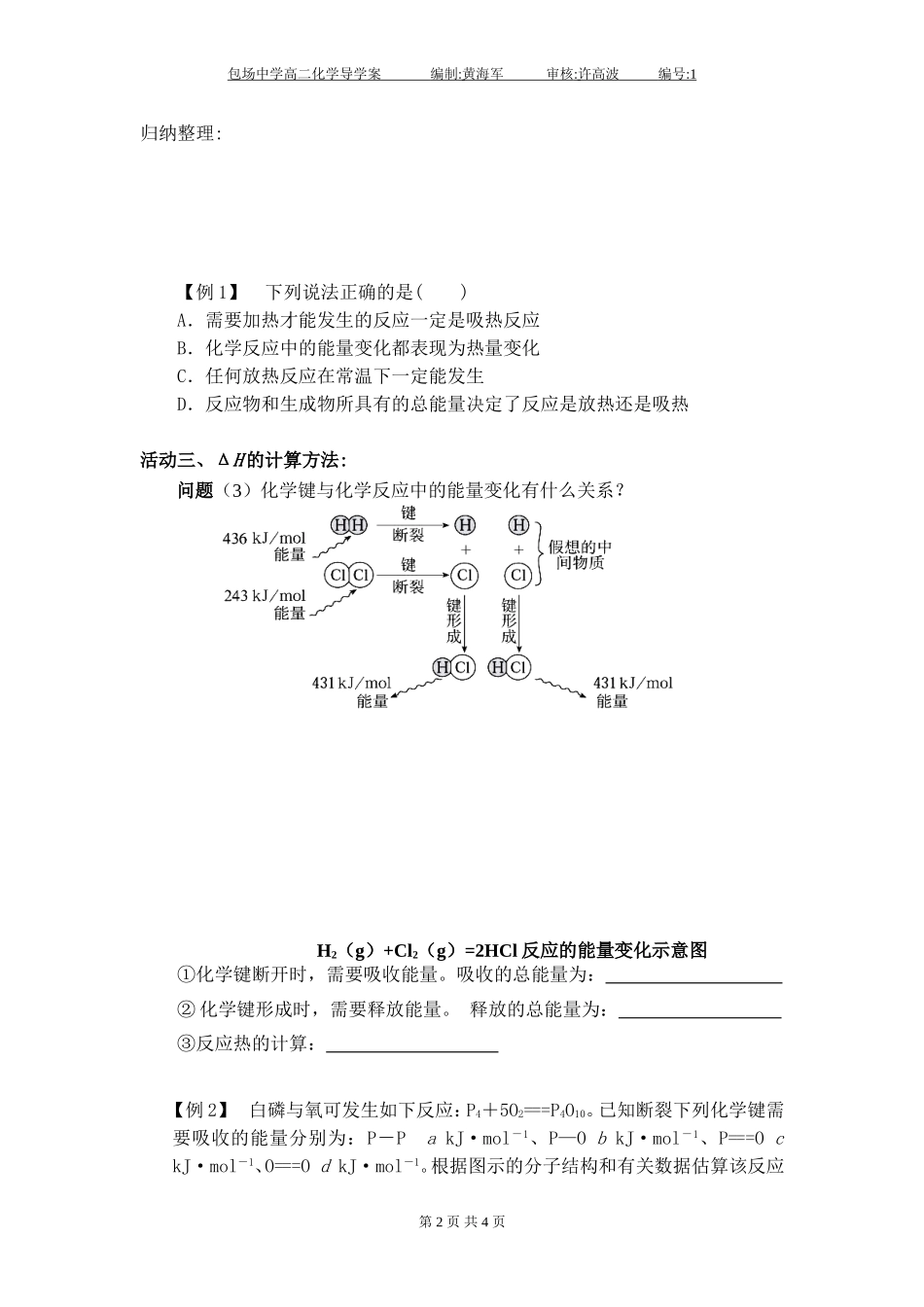
包场中学高二化学导学案编制:黄海军审核:许高波编号:1第一章化学反应与能量第一节化学反应与能量的变化[学习目标]1.记住焓变的含义,能判断反应是放热还是吸热。2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。3.能从微观角度,运用化学键的知识,解释化学反应过程中能量变化的原因。[重点·难点]重点:焓变、反应热的概念。难点:从化学键角度认识化学反应能量变化的原因。活动一、反应热焓变问题(1)你知道如何表示一个反应的反应热吗?(2)反应热与焓变之间存在什么样的关系?1、概念:化学反应过程中所的能量,都可以热量(或转换成相应的热量)来表述,叫做反应热,又称为“”。符号:,单位:2、反应热的表示方法:放热反应:体系环境,体系将能量释放给环境,体系的能量降低,因此,放热反应的ΔH0,为“”吸热反应:环境体系,体系吸收了环境的能量,体系的能量升高,因此,吸热反应的ΔH0,为“”化学变化过程中的能量变化见下图:图1为反应,ΔH10;图2为反应,ΔH20。活动二、常见的吸热和放热反应:思考:下列反应属于放热反应的是()A.Al与稀盐酸反应B.C+CO2=====2COC.KClO3受热分解D.NaOH溶于水第1页共4页能量能量包场中学高二化学导学案编制:黄海军审核:许高波编号:1归纳整理:【例1】下列说法正确的是()A.需要加热才能发生的反应一定是吸热反应B.化学反应中的能量变化都表现为热量变化C.任何放热反应在常温下一定能发生D.反应物和生成物所具有的总能量决定了反应是放热还是吸热活动三、ΔH的计算方法:问题(3)化学键与化学反应中的能量变化有什么关系?H2(g)+Cl2(g)=2HCl反应的能量变化示意图①化学键断开时,需要吸收能量。吸收的总能量为:②化学键形成时,需要释放能量。释放的总能量为:③反应热的计算:【例2】白磷与氧可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P-PakJ·mol-1、P—ObkJ·mol-1、P===OckJ·mol-1、O===OdkJ·mol-1。根据图示的分子结构和有关数据估算该反应第2页共4页包场中学高二化学导学案编制:黄海军审核:许高波编号:1的ΔH,其中正确的是()A.(6a+5d-4c-12b)kJ·mol-1B.(4c+12b-6a-5d)kJ·mol-1C.(4c+12b-4a-5d)kJ·mol-1D.(4a+5d-4c-12b)kJ·mol-1知识迁移:判断物质的稳定性已知:C(石墨s)C(金刚石s)ΔH=+700kJ/mol【思考】:石墨与金刚石哪个稳定?石墨能否自动转化为金刚石?课堂练习1.下列反应既属于氧化还原反应,又属于吸热反应的是()A.铝片和稀盐酸反应B.Ba(OH)2·8H2O与NH4Cl的反应C.灼热的碳与二氧化碳的反应D.甲烷在氧气中的燃烧2.已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ,下列关系式正确的是()A.Q1+Q2>Q3B.Q1+Q2>2Q3C.Q1+Q20的化学反应C.形成化学键时共放出能量862kJ的化学反应D.能量变化如图所示的化学反应4.下列有关反应:4NH3(g)+5O2(g)===4NO(g)+6H2O(g)△H(298K)=-905kJ·mol-1的描述不正确的是()A.生成物的总能量小于反应物的总能量B.该反应为吸热反应C.该反应为放热反应第3页共4页包场中学高二化学导学案编制:黄海军审核:许高波编号:1D.该反应中每4molNH3(g)被氧化,放出905kJ热量5.对于放热反应2H2(g)+O2(g)===2H2O(l),下列说法正确的是()A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量D.无法确定6.在一定条件下,A和B反应可生成C和D,其能量变化如下:(反应前)(反应后)(1)下列有关反应A+B===C+D的说法正确的是________。A.反应前后原子的种类和数目一定不变B.该反应若有热量变化,则一定是氧化还原反应C.若该反应为放热反应,则不需加热反应就一定能自发进行D.反应物的总质量与生成物的总质量一定相等,且遵循能量守恒(2)若...