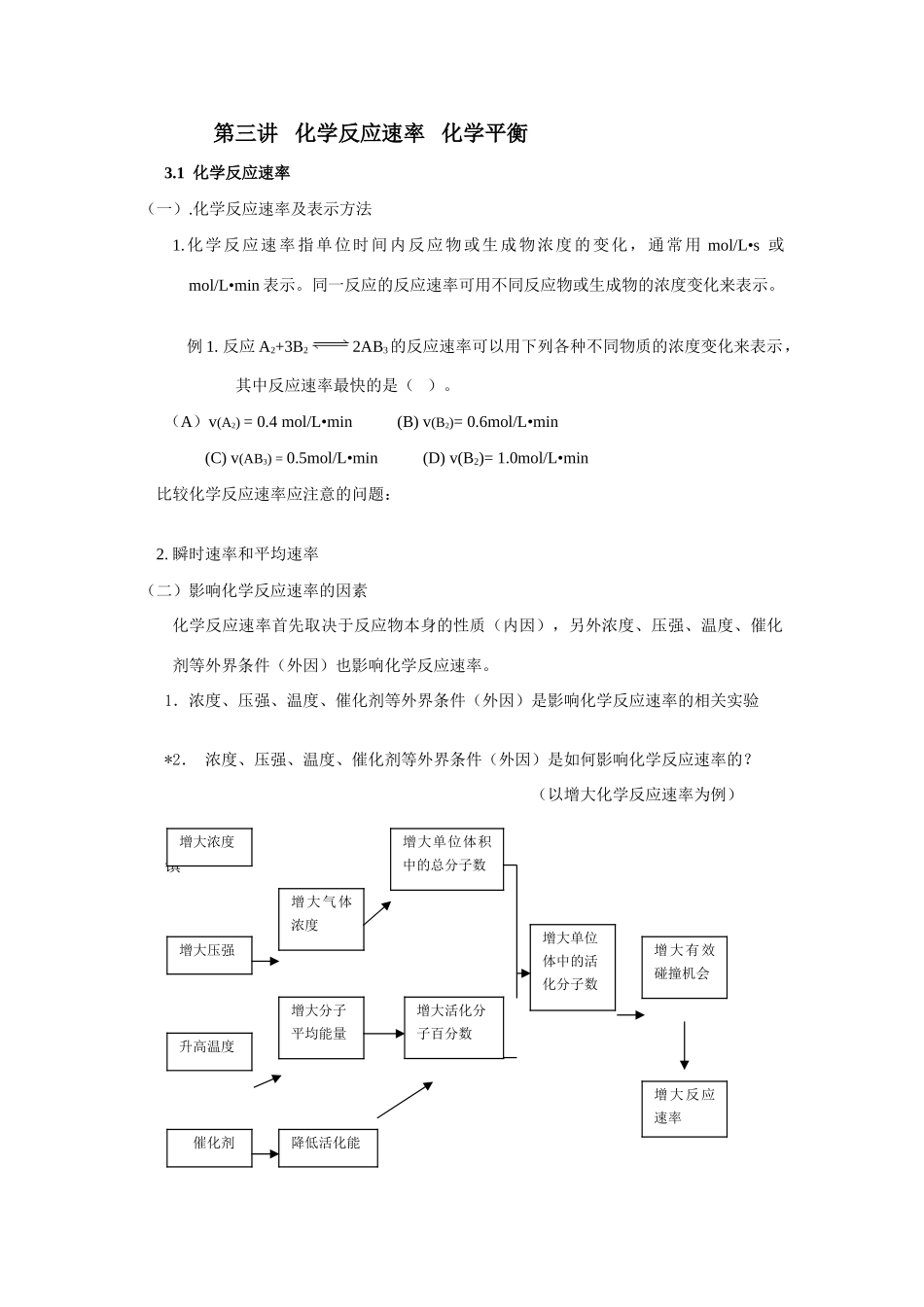
第三讲化学反应速率化学平衡3.1化学反应速率(一).化学反应速率及表示方法1.化学反应速率指单位时间内反应物或生成物浓度的变化,通常用mol/L•s或mol/L•min表示。同一反应的反应速率可用不同反应物或生成物的浓度变化来表示。例1.反应A2+3B22AB3的反应速率可以用下列各种不同物质的浓度变化来表示,其中反应速率最快的是()。(A)v(A2)=0.4mol/L•min(B)v(B2)=0.6mol/L•min(C)v(AB3)=0.5mol/L•min(D)v(B2)=1.0mol/L•min比较化学反应速率应注意的问题:2.瞬时速率和平均速率(二)影响化学反应速率的因素化学反应速率首先取决于反应物本身的性质(内因),另外浓度、压强、温度、催化剂等外界条件(外因)也影响化学反应速率。1.浓度、压强、温度、催化剂等外界条件(外因)是影响化学反应速率的相关实验*2.浓度、压强、温度、催化剂等外界条件(外因)是如何影响化学反应速率的?(以增大化学反应速率为例)镇增大浓度增大压强升高温度催化剂增大气体浓度增大分子平均能量增大单位体积中的总分子数增大活化分子百分数增大单位体中的活化分子数增大有效碰撞机会增大反应速率降低活化能*3.催化剂的特性例1.化学反应A+BC+D,在以下各组不同条件下进行时,反应速率最大的一组是()(A)常温下20ml含A和B各0.001mol的溶液(B)常温下50ml含A和B各0.01mol的溶液(C)常温下,将0。3mol/L的A、B溶液各10ml混合(D)标准状况下,将0。3mol/L的A、B溶液各20ml混合2.Fe3+和I-在水溶液中的反应如下:2Fe3++2I-→2Fe2++I2,该反应的反应速率和Fe3+、I-的浓度关系如下:V=R[c(I-)]m[c(Fe3+)]n(R为常数)c(I-)(mol/L)C(Fe3+)(mol/L)V[mol/L•s]①0.200.800.032R②0.600.400.144R②0.800.200.128R(1)通过计算得知:V=R[c(I-)]m[c(Fe3+)]n中m、n的值为_________________.(A)m=1n=1(B)m=1n=2(C)m=2n=1(D)m=2n=2(1)有此可见,该反应中I-浓度对反应速率的影响_____________Fe3+浓度对反应速率的影响。(填大于、小于、等于)3.2化学中的平衡(一)化学平衡的特征①动态平衡:V(正)=V(逆)≠0②各反应物、生成物的浓度不变,反应混合物中各组成成分的百份含量保持不变③外界条件改变时平衡可能发生移动例:,可逆反应N2+3H22NH3,用Vx表示正反应速率,V/x表示逆反应速率,在下列各种关系中不可能存在的是___________,能证明反应已达到平衡的是().(A)V(N2)==1/3V(H2)(B)V(N2)==V(H2)(C)V(N2)==V/(NH3)(D)V(H2)==3V/(N2)(E)V/(H2)==2/3V(NH3)归纳:通过不同物质所表示的反应速率证明反应已达到平衡状态应满足的条件是______________________________________________________________________。平衡转化率例1.某温度时,在一个密闭的恒压容器中将1体积SO2和3体积O2混和后反应:2SO2+O22SO3.平衡时测得SO2的转化率为40%,求反应前后混合气体的密度比。解题要点:该反应为气体总质量不变的反应,密度ρ=m/V,即气体密度与体积成反比。2.在密闭容器中,用等物质的量的A和B发生反应:A(g)+2B(g)2C(g),当达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为()。(A)40%(B)50%(C)60%(D)70%(96-q)化学平衡常数1.定义及关系式2.用平衡常数讨论化学平衡移动中的有关问题二.化学平衡的移动(一)反应条件对化学平衡的影响1.浓度2.压强V(g)一定(恒容)、n(g)与P(压强)正比P(g)一定(恒压)、n(g)与V(g)正比n(g)一定P(g)与V(g)反比例1.当反应xAyB达到平衡状态时,增大压强并讨论:例2.在恒容容器中加入1mol气体A发生反应:xAyB达到平衡状态时,再加入1mol气体A并讨论:①若X=Y,平衡移动方向_______,当反应重新达到平衡时,气体A的转化率_____。②若X>Y,平衡移动方向_______,当反应重新达到平衡时,气体A的转化率_____。③若X0)在不同的温度和不同的压...