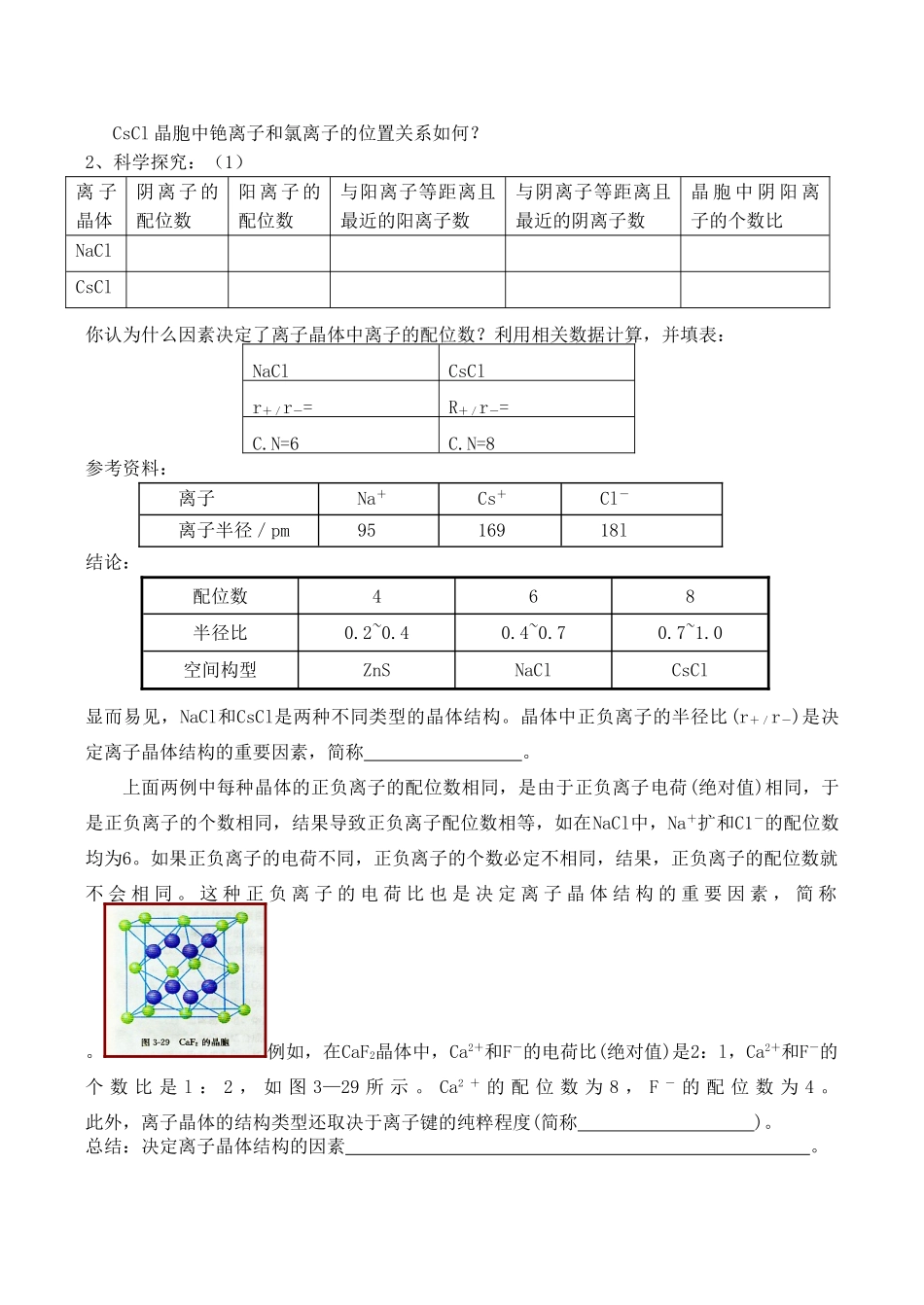
高二化学选修3《离子晶体》学案设计设计者:邱日兵一、学习目标:1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。2.学会离子晶体的性质与晶胞结构的关系。3.通过探究知道离子晶体的配位数与离子半径比的关系。4、通过碳酸盐的热分解温度与阳离子半径的自学,拓展学生视野。学习方法建议:分析、归纳、讨论、探究二、学习过程(一)预习导学1、什么是离子键?离子键的存在范围有哪些?什么是离子化合物?2、下列物质中哪些是离子化合物?哪些是只含离子键的离子化合物?Na2ONH4ClO2Na2SO4NaClCsClCaF23、我们已经学习过几种晶体?它们的结构微粒和微粒间的相互作用分别是什么?它们的有关理论是怎么样的?4、离子晶体是晶体。5、在离子晶体中,离子间存在着较强的,使离子晶体的硬度,难于;要使离子晶体由固态变为液态或气态,需要较多的能量破坏。因此,一般地说,离子晶体有较高的和。6、离子晶体的配位数是指,影响离子晶体配位数的因素有:。7、晶格能是,通常取值,影响晶格能大小的因素是,这些影响因素与晶格能的关系是:;晶格能越大,形成的离子晶体越,而且熔点,硬度。8、科学视野视野自学提示:(1)碳酸盐在一定温度下发生分解的规律?(2)影响了岩浆晶出的次序的因素?岩浆晶出的次序规律如何?(即:岩浆晶出的次序与晶格能的大小有何关系?)(二)知识点拔1、NaCl晶胞中钠离子和氯离子的位置关系如何?CsCl晶胞中铯离子和氯离子的位置关系如何?2、科学探究:(1)离子晶体阴离子的配位数阳离子的配位数与阳离子等距离且最近的阳离子数与阴离子等距离且最近的阴离子数晶胞中阴阳离子的个数比NaClCsCl你认为什么因素决定了离子晶体中离子的配位数?利用相关数据计算,并填表:NaClCsClr+/r-=R+/r-=C.N=6C.N=8参考资料:离子Na+Cs+Cl-离子半径/pm9516918l结论:配位数468半径比0.2~0.40.4~0.70.7~1.0空间构型ZnSNaClCsCl显而易见,NaCl和CsCl是两种不同类型的晶体结构。晶体中正负离子的半径比(r+/r-)是决定离子晶体结构的重要因素,简称。上面两例中每种晶体的正负离子的配位数相同,是由于正负离子电荷(绝对值)相同,于是正负离子的个数相同,结果导致正负离子配位数相等,如在NaCl中,Na+扩和C1-的配位数均为6。如果正负离子的电荷不同,正负离子的个数必定不相同,结果,正负离子的配位数就不会相同。这种正负离子的电荷比也是决定离子晶体结构的重要因素,简称。例如,在CaF2晶体中,Ca2+和F-的电荷比(绝对值)是2:l,Ca2+和F-的个数比是l:2,如图3—29所示。Ca2+的配位数为8,F-的配位数为4。此外,离子晶体的结构类型还取决于离子键的纯粹程度(简称)。总结:决定离子晶体结构的因素。(2)离子晶体的晶格能与哪些因素有关?晶格能的大小与离子晶体的熔沸点有什么关系?F—C1一Br—I—Li+Na+K+Cs+Rb+103692382178574085378671568965980774768266063l757704649630604AB型离子晶体离子电荷晶格能(KJ/mol-1)熔点摩氏硬度NaF19239933.2NaCl17868012.5NaBr1747747<2.5NaI1704661<2.5MgO2379128526.5CaO2340126144.5SrO2322324303.5BaO2305419183.3规律:。[随堂练习]:第一课时:1、下列有关离子化合物的说法正确的是()A、离子化合物中一定含有金属元素,含金属元素的化合物一定是离子化合物B、离子键只存在于离子化合物中,离子化合物中一定含有离子键C、离子化合物中不可能含有共价键D、离子化合物受热熔化破坏化学键,吸收热量,属于化学变化2、离子晶体不可能具有的性质是()A、较高的熔、沸点B、良好的导电性C、溶于极性溶剂D、坚硬而易粉碎3、下列性质适合于离子晶体的是()A、熔点1070℃,易溶于水,水溶液能导电氟化物晶格能/kJ·mol-1NaF923MgF22957AlF35492B、熔点10.31℃,液态不导电,水溶液导电C、能溶于CS2,熔点112.8℃,沸点444.6℃D、熔点97.81℃,质软,导电,密度0.97g/cm34、如右图所示,在氯化钠晶体中,与每个Na+等距离且最近的几个Cl-所围成的空间几何构型()A、十二面体B、正八面体C、正六面体D、正四面体5、CaF2晶体中正离子配位数8,负离子配位数为。TiO2晶体中正离子的配位数为...