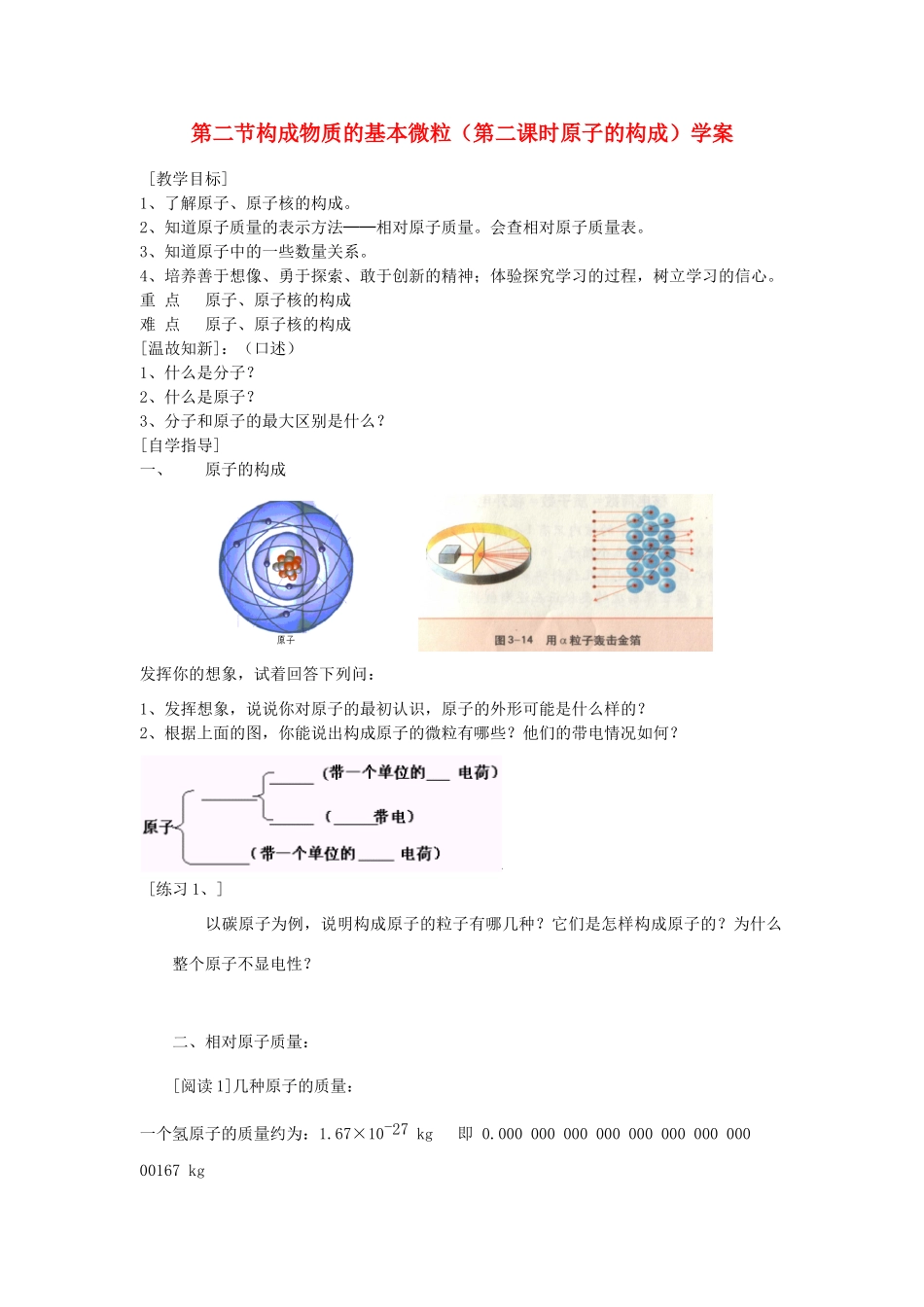
第二节构成物质的基本微粒(第二课时原子的构成)学案[教学目标]1、了解原子、原子核的构成。2、知道原子质量的表示方法──相对原子质量。会查相对原子质量表。3、知道原子中的一些数量关系。4、培养善于想像、勇于探索、敢于创新的精神;体验探究学习的过程,树立学习的信心。重点原子、原子核的构成难点原子、原子核的构成[温故知新]:(口述)1、什么是分子?2、什么是原子?3、分子和原子的最大区别是什么?[自学指导]一、原子的构成发挥你的想象,试着回答下列问:1、发挥想象,说说你对原子的最初认识,原子的外形可能是什么样的?2、根据上面的图,你能说出构成原子的微粒有哪些?他们的带电情况如何?[练习1、]以碳原子为例,说明构成原子的粒子有哪几种?它们是怎样构成原子的?为什么整个原子不显电性?二、相对原子质量:[阅读1]几种原子的质量:一个氢原子的质量约为:1.67×10-27kg即0.00000000000000000000000000167kg一个碳原子的质量约为:1.993×10-26kg即0.00000000000000000000000001993kg一个氧原子的质量约为:2.657×10-26kg即0.00000000000000000000000002657kg一个铁原子的质量约为:9.288×10-26kg即0.00000000000000000000000009288kg[思考1]看上面几种原子的质量,你认为为什么要引进相对原子质量?[阅读2][思考2]看课本68页和上面的图,写出相对原子质量的计算公式?相对原子质量=[练习]2、从元素周期表中查阅下列元素的相对原子质量:Na=O=Mg=3、氢的相对原子质量为()A.1gB.1kgC.1D.1.67×10-27kg4、若标准碳原子的质量为m,某种原子的相对质量为n,求这种原子的实际质量三、原子中的几个数量关系[思考3]观察下表,回答质子数、核外电子数有何关系?氢原子有没有中了?相对原子质量和质子数、中子数有何关系?[练习]5、根据所学内容,完成下列表格中的数据。6、2000年3月美国铱星公司宣布破产。铱星公司原计划发射77颗卫星以实现全球卫星通讯,发射卫星的数目与铱元素原子核外电子数相等。下列关于铱元素的各种说法中,不正确的是()A、铱原子的质子数为77B、铱原子的相对原子质量为77C、铱原子的核电荷数为77D、铱原子的核外电子数为77练习答案:1.构成原子的粒子有电子、质子和中子;质子和中子构成原子核,电子在原子核外绕核做高速运动;因为1个电子带1个单位负电荷,1个质子带1个单位正电荷,中子不带电,在原子中,电子数等于质子数,即电子所带的负电荷总数等于质子所带正电荷总数,所以原子对外不显电性2.23;16;243.C4.mn/125.6;12;6;16;16;16;26;56;266.B