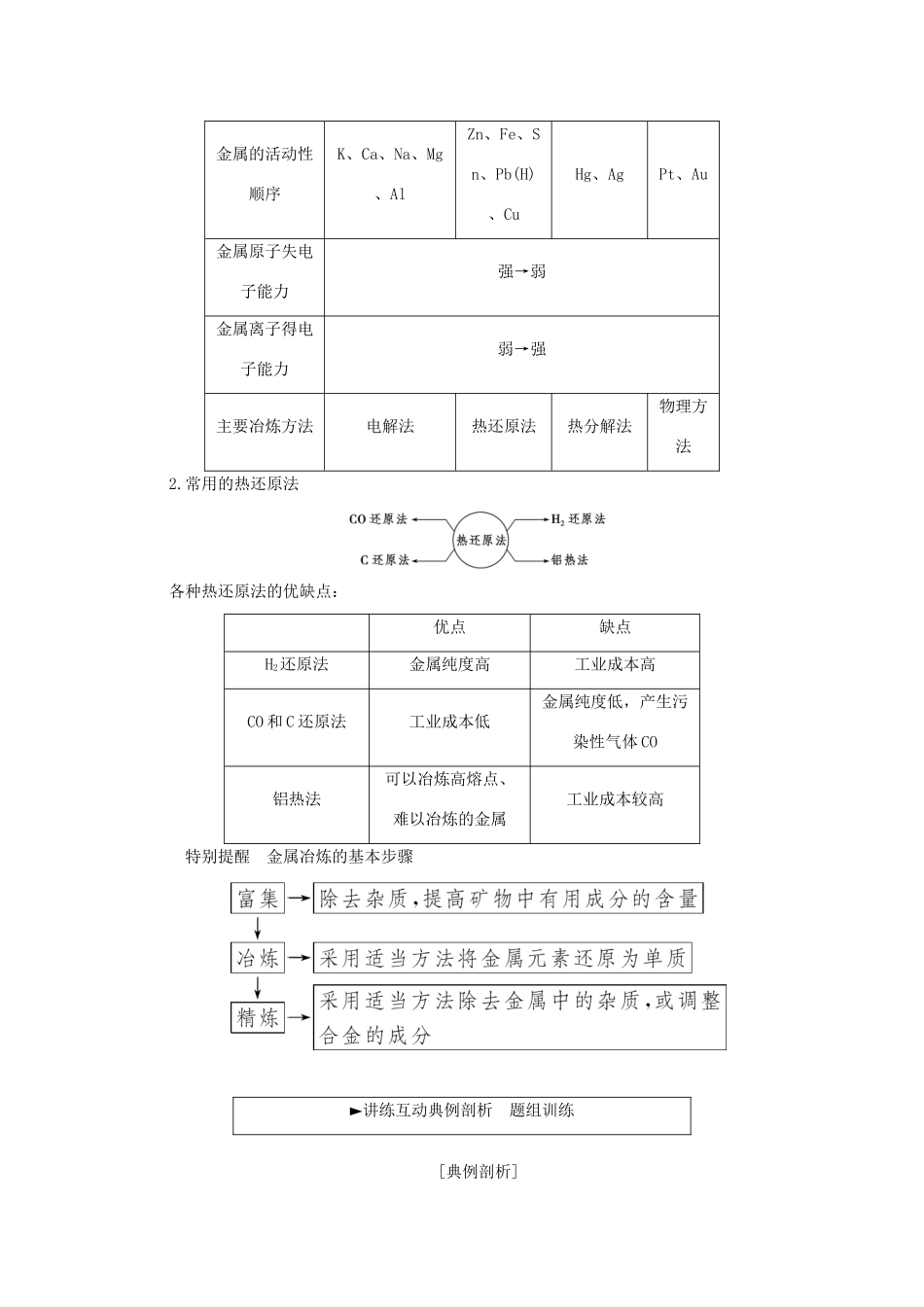
第四章化学与自然资源的开发利用[课程标准]1.以海水、金属矿物等自然资源的综合利用为例,了解化学方法在实现物质间转化中的作用。认识化学在自然资源综合利用方面的重要价值。2.以酸雨的防治和无磷洗涤剂的使用为例,体会化学对环境保护的意义。3.能说明合成新物质对人类生活的影响,讨论在化工生产中遵循“绿色化学”思想的重要性。第一节开发利用金属矿物和海水资源第1课时金属矿物的开发利用[学习目标]1.了解金属在自然界中的存在形式。2.掌握金属的冶炼方法。3.掌握铝热反应原理及实验。4.了解金属回收和资源保护的意义。5.认识和体会化学在自然资源开发和利用中的意义和作用。知识点一金属的冶炼►自主探究自主学习探究归纳阅读教材P88~P90,思考并填空一、金属在自然界中的存在形态二、金属的冶炼1.热分解法适用于不活泼金属的冶炼。请写出下列反应的化学方程式。(1)加热分解HgO:2HgO=====2Hg+O2↑。(2)加热分解Ag2O:2Ag2O=====4Ag+O2↑。2.电解法适用于非常活泼金属的冶炼。请写出下列反应的化学方程式。(1)冶炼金属钠,电解熔融NaCl:2NaCl(熔融)=====2Na+Cl2↑。(2)冶炼金属镁,电解熔融MgCl2:MgCl2(熔融)=====Mg+Cl2↑。(3)冶炼金属铝,电解熔融Al2O3:2Al2O3(熔融)=====4Al+3O2↑。3.热还原法适用于大多数中等活泼金属的冶炼,常用的还原剂有C、H2、CO等。请写出下列冶炼金属反应的化学方程式。(1)高炉炼铁:3CO+Fe2O3=====2Fe+3CO2。(2)铝热反应炼铁:2Al+Fe2O3=====2Fe+Al2O3。(3)用氢气还原氧化铜:H2+CuO=====Cu+H2O。4.其他方法(1)火法炼铜:Cu2S+O2=====2Cu+SO2。(2)湿法炼铜:Fe+CuSO4===FeSO4+Cu。三、金属资源的合理开发利用1.合理开发利用金属资源的意义:金属矿物资源是不可再生资源且贮量有限,冶炼过程中会消耗大量能量,也易造成环境污染。故应合理开发利用金属资源。2.有效利用金属资源的途径(1)提高金属矿物的利用率;(2)减少金属的使用量;(3)加强金属资源的回收和再利用;(4)使用其他材料代替金属材料。自我测评►———————————————————(做一做)1.判断正误:(1)黄金的冶炼需要热分解法。(×)分析:金在自然界中以游离态存在,无需进行冶炼。(2)金属阳离子被还原,一定得到金属单质。(×)分析:变价金属元素的最高价阳离子被还原时,可能得到中间价态的离子,而不一定得到金属单质,如Fe3+可被还原成Fe2+。(3)金属冶炼的实质是把金属从化合态还原为游离态。(√)分析:金属冶炼的实质是利用氧化还原反应将金属从化合物中还原出来。2.思考:利用CO冶炼铁的反应是置换反应吗?提示:不是。CO冶炼铁的反应是3CO+Fe2O3=====2Fe+3CO2,该反应不是置换反应。[认知总结]金属的活动性与冶炼方法1.金属活动性顺序与金属冶炼方法的关系金属的活动性顺序K、Ca、Na、Mg、AlZn、Fe、Sn、Pb(H)、CuHg、AgPt、Au金属原子失电子能力强→弱金属离子得电子能力弱→强主要冶炼方法电解法热还原法热分解法物理方法2.常用的热还原法各种热还原法的优缺点:优点缺点H2还原法金属纯度高工业成本高CO和C还原法工业成本低金属纯度低,产生污染性气体CO铝热法可以冶炼高熔点、难以冶炼的金属工业成本较高特别提醒金属冶炼的基本步骤►讲练互动典例剖析题组训练[典例剖析]冶炼金属一般有下列4种方法:①焦炭法;②水煤气(或氢气、一氧化碳)法;③活泼金属置换法;④电解法。这4种方法在工业上均有应用。古代有:Ⅰ.火烧孔雀石炼铜;Ⅱ.湿法炼铜。现代有:Ⅲ.铝热法炼铬;Ⅳ.从光卤石(MgCl2·6H2O)中炼镁。对它们的冶炼方法的分类,不正确的是()A.Ⅰ,①B.Ⅱ,②C.Ⅲ,③D.Ⅳ,④[解析]金属冶炼方法的选择与金属在自然界中存在的状态、金属活动性等有关,需要在理解的基础上加以记忆。Ⅰ、Ⅱ、Ⅲ、Ⅳ发生的反应分别是Ⅰ.Cu2(OH)2CO3=====2CuO+CO2↑+H2O,C+2CuO=====2Cu+CO2↑;Ⅱ.Fe+CuSO4===FeSO4+Cu;Ⅲ.2Al+Cr2O3=====Al2O3+2Cr;Ⅳ.先从光卤石中提取MgCl2,再电解熔融的MgCl2:MgCl2(熔融)=====Mg+Cl2↑。则Ⅰ属于方法①,Ⅱ属于方法③,Ⅲ属于方法③,Ⅳ属于方法④。综上分析,B选项不正确。[答案]B[规...