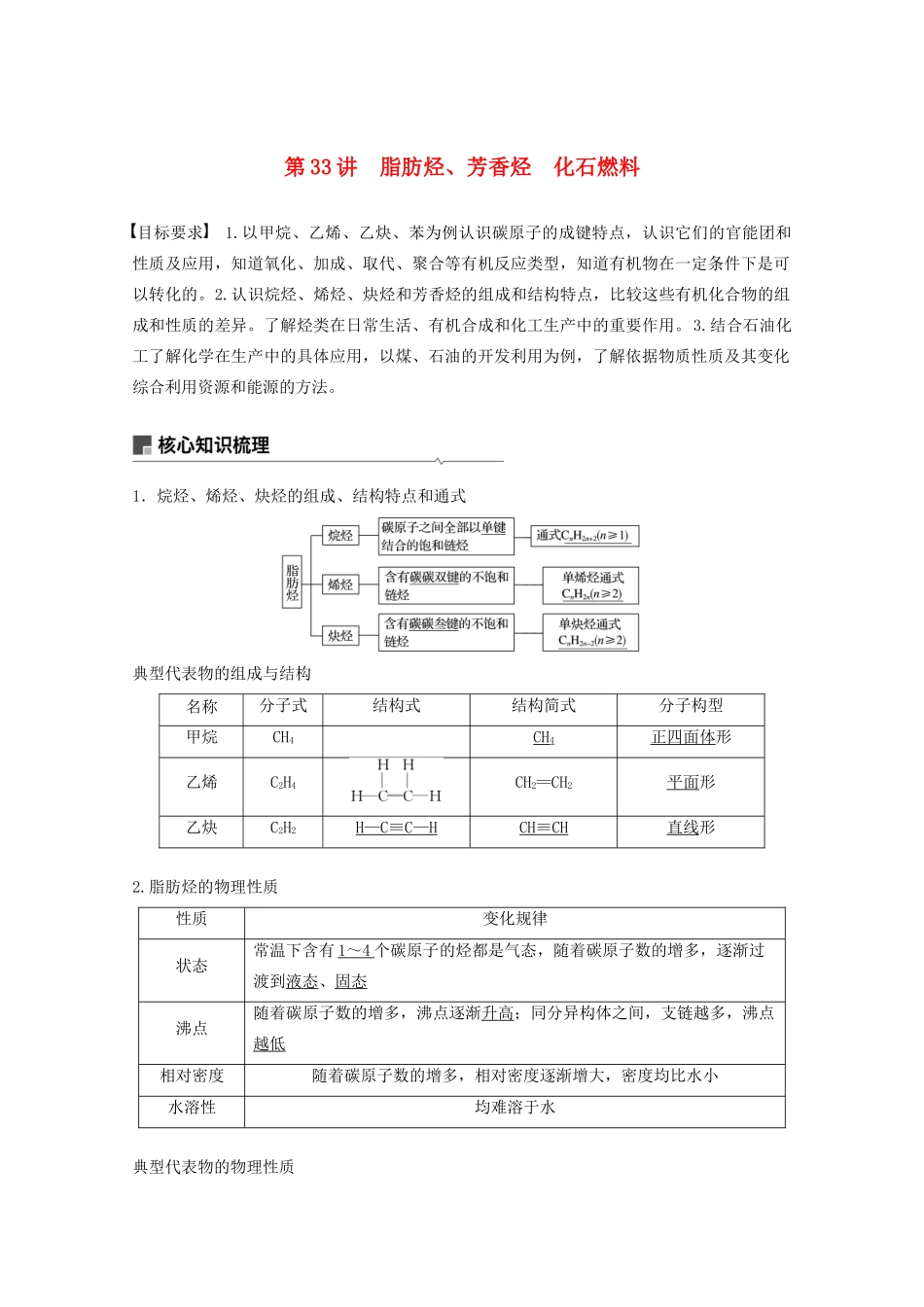
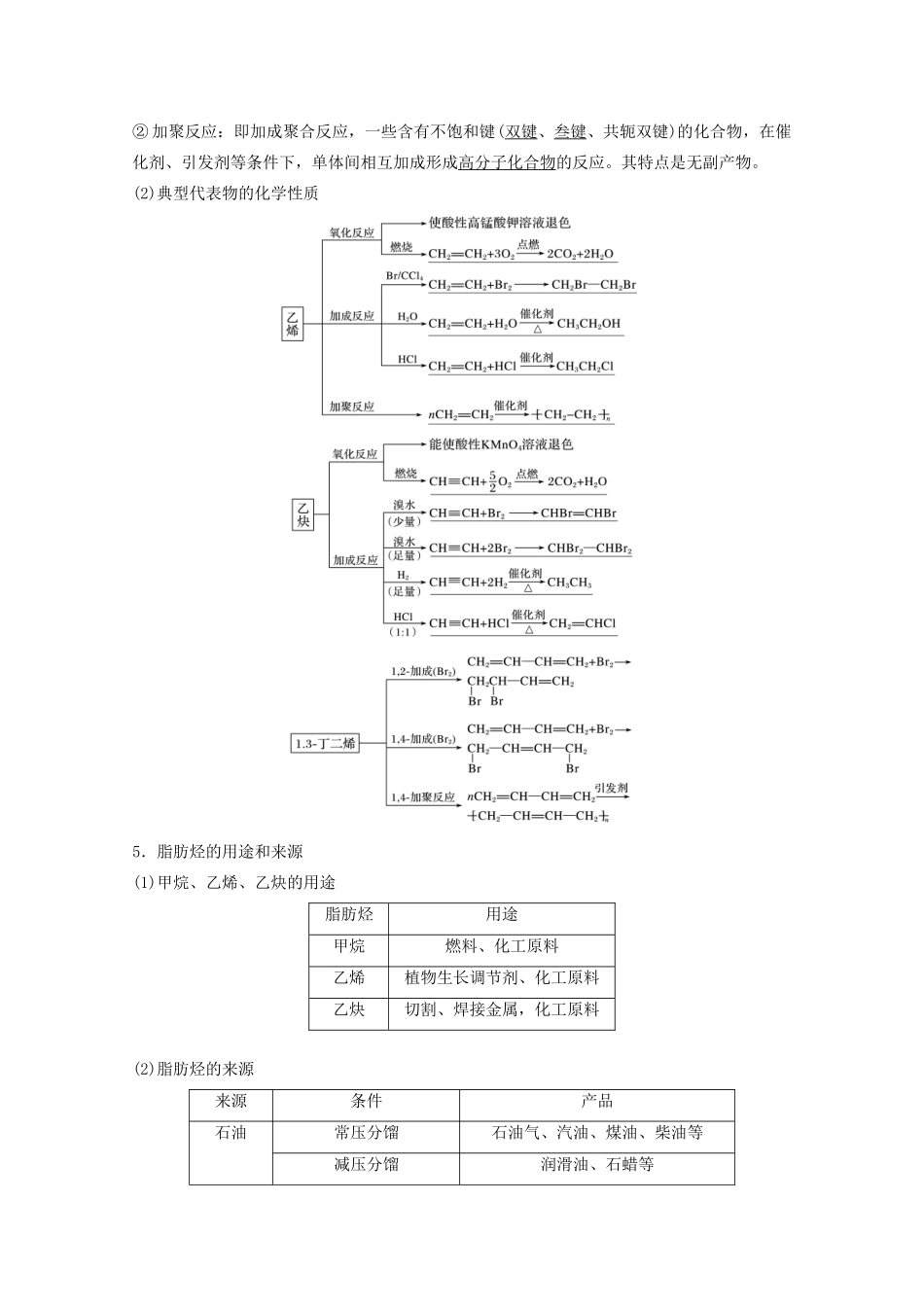
第33讲脂肪烃、芳香烃化石燃料目标要求1.以甲烷、乙烯、乙炔、苯为例认识碳原子的成键特点,认识它们的官能团和性质及应用,知道氧化、加成、取代、聚合等有机反应类型,知道有机物在一定条件下是可以转化的。2.认识烷烃、烯烃、炔烃和芳香烃的组成和结构特点,比较这些有机化合物的组成和性质的差异。了解烃类在日常生活、有机合成和化工生产中的重要作用。3.结合石油化工了解化学在生产中的具体应用,以煤、石油的开发利用为例,了解依据物质性质及其变化综合利用资源和能源的方法。1.烷烃、烯烃、炔烃的组成、结构特点和通式典型代表物的组成与结构名称分子式结构式结构简式分子构型甲烷CH4CH4正四面体形乙烯C2H4CH2==CH2平面形乙炔C2H2H—C≡C—HCH≡CH直线形2.脂肪烃的物理性质性质变化规律状态常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态沸点随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低相对密度随着碳原子数的增多,相对密度逐渐增大,密度均比水小水溶性均难溶于水典型代表物的物理性质烃类颜色状态气味密度水溶性甲烷无色气态无味小于空气极难溶乙烯稍有气味难溶乙炔无味微溶3.烷烃的化学性质应用举例(1)烷烃(CnH2n+2)燃烧的通式为:__________________。(2)烷烃代表物与氯气在光照下的卤代反应①甲烷与氯气反应(只写一个方程式即可):CH4+2Cl2――→________________。②乙烷与氯气反应(只写一种方程式即可):CH3CH3+Cl2――→________________。答案(1)CnH2n+2+O2――→nCO2+(n+1)H2O(2)①CH2Cl2+2HCl②CH3CH2Cl+HCl(1)取代反应:有机物分子中某些原子或原子团被其他原子或原子团所替代的反应。(2)烷烃的卤代反应特点①反应条件:气态烷烃与气态卤素单质在光照下反应。②产物成分:多种卤代烃混合物(非纯净物)+HX。③定量关系:~Cl2~HCl即取代1mol氢原子,消耗1mol卤素单质,生成1molHCl。4.烯烃、炔烃的化学性质(1)概念①加成反应:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。②加聚反应:即加成聚合反应,一些含有不饱和键(双键、叁键、共轭双键)的化合物,在催化剂、引发剂等条件下,单体间相互加成形成高分子化合物的反应。其特点是无副产物。(2)典型代表物的化学性质5.脂肪烃的用途和来源(1)甲烷、乙烯、乙炔的用途脂肪烃用途甲烷燃料、化工原料乙烯植物生长调节剂、化工原料乙炔切割、焊接金属,化工原料(2)脂肪烃的来源来源条件产品石油常压分馏石油气、汽油、煤油、柴油等减压分馏润滑油、石蜡等催化裂化、裂解轻质油、气态烯烃催化重整芳香烃天然气—甲烷煤煤焦油的分馏芳香烃直接或间接液化燃料油、多种化工原料6.乙烯和乙炔的实验室制法乙烯乙炔原理CH3CH2OH―――→CH2==CH2↑+H2OCaC2+2H2O―→Ca(OH)2+HC≡CH↑反应装置收集方法排水集气法排水集气法或向下排空气法拓展延伸烯烃、炔烃被酸性KMnO4溶液氧化产物规律应用举例某烃的分子式为C11H20,1mol该烃在催化剂作用下可以吸收2molH2;用热的酸性KMnO4溶液氧化,得到丁酮()、琥珀酸()和丙酮()三者的混合物。该烃的结构简式:________________________________________________________。答案(1)1molCH4与1molCl2在光照条件下反应,生成1molCH3Cl气体(×)(2)乙烯可做水果的催熟剂(√)(3)甲烷中含有乙烯气体,可通过酸性高锰酸钾溶液除去(×)(4)甲烷和乙烯可用溴的四氯化碳溶液鉴别(√)(5)正丁烷的四个碳原子在同一条直线上,丙烯的所有原子在同一平面内(×)(6)用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的(√)(7)将某气体通入溴水中,溴水颜色退色,该气体一定是乙烯(×)(8)“瓦斯”是乙烯与空气组成的混合物(×)(9)沼气的主要成分是甲烷,是一种可再生清洁能源(√)(10)符合通式CnH2n+2的烃一定是烷烃(√)(11)聚丙烯可发生加成反应(×)(12)烷烃同分异构体之间,支链越多,沸点越高(×)题组一烷、烯、炔烃的结构与性质1.己烷、己烯、己炔共同具有的性质是()A.都不溶于水,且密度比水的小B.能够使溴水和酸性KMnO4溶液退色C.分子中各原子都处在同一平面上D....