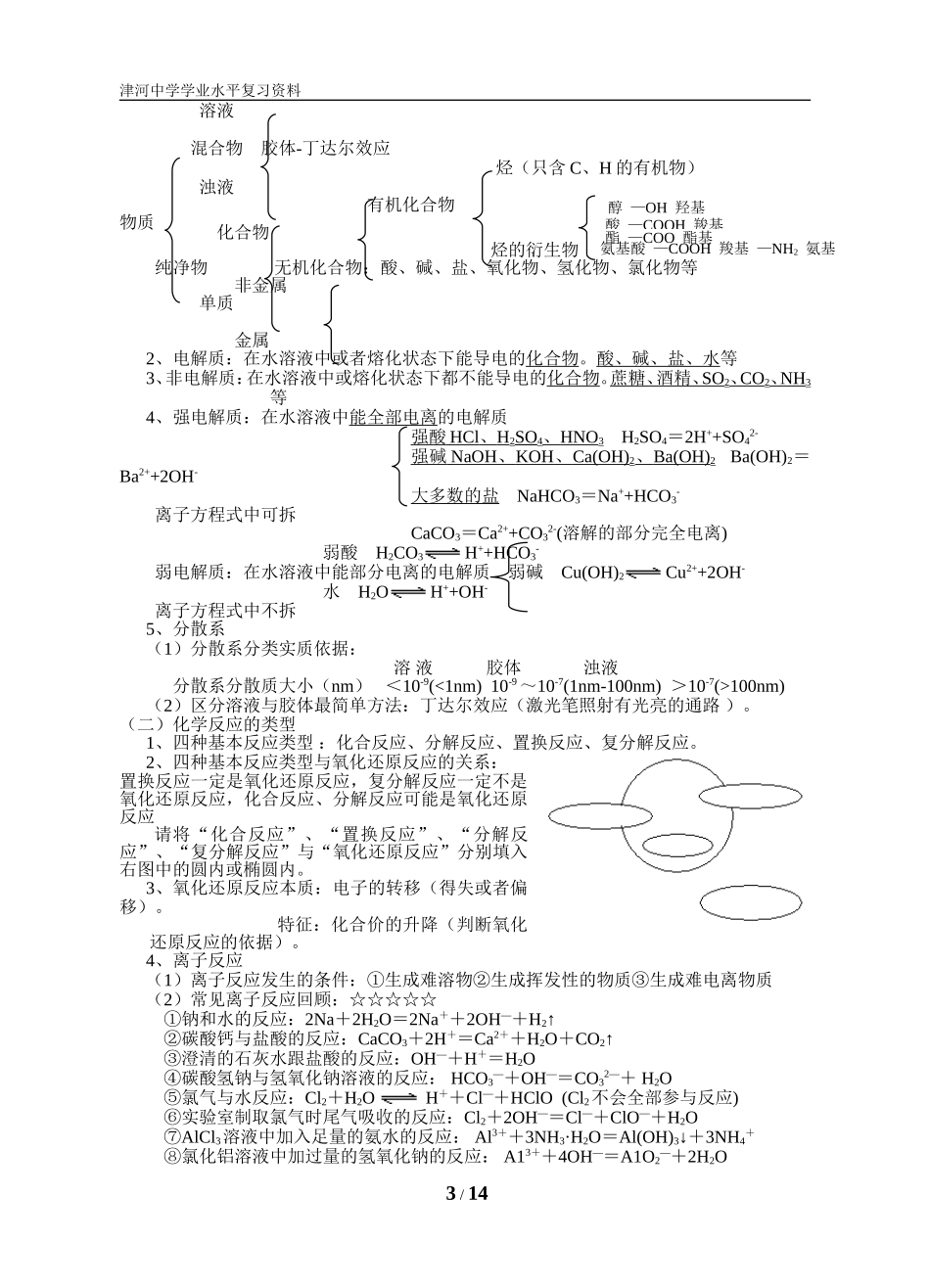
津河中学学业水平复习资料津河中学2015届高三学业水平测试化学复习提纲一、基础实验与基本实验操作(一)物质的分离与提纯的基本实验方法1、过滤:适用于分离一种组分可溶、另一种不溶的固态混合物的分离。如:粗盐与泥沙的分离提纯。主要仪器:漏斗、玻璃棒、烧杯。2、蒸发结晶:适用于混合物中各组分物质在溶剂中存在溶解性差异的分离提纯如:NaCl中混有KNO3分离提纯。主要仪器:蒸发皿、玻璃棒、酒精灯。3、蒸馏法:适用于分离各组分互溶,但沸点不同的液态混合物。如:酒精与水的分离。主要仪器:蒸馏烧瓶、冷凝器(管)、温度计、接收器、锥形瓶。4、分液:分离互不相溶的两种液体。主要仪器:分液漏斗、铁架台、铁圈。5、萃取:溶质在互不相溶的溶剂里溶解度不同,利用萃取剂将溶质从另一溶剂中分离出来。主要仪器:分液漏斗。附:溴和碘在水溶液和有机溶剂(苯或四氯化碳)中的颜色单质水溶液有机溶剂(苯或四氯化碳)溴深红棕色液体浅黄色→黄色橙色→橙红色碘紫黑色固体黄色→棕黄色浅紫色→紫色注意:萃取溴水的溴苯-上层;四氯化碳-下层(二)离子的检验与鉴别1、Na+:焰色反应-黄色2、K+:焰色反应-透过蓝色钴玻璃为紫色3、NH4+:加入强碱,加热可产生可使湿润红色石蕊试纸变蓝色的气体NH4++OH-NH3↑+H2O4、Fe3+检验:加入KSCN溶液后溶液变成红色溶液(非沉淀)Fe3++3SCN―=Fe(SCN)35、Cl-:加入用稀HNO3酸化(排除CO32-等离子的干扰)的AgNO3溶液,有白色沉淀产生。Ag++Cl―=AgCl↓6、SO42-:先加入足量稀HCl酸化(排除Ag+、CO32-和SO32-等离子的干扰),然后加入BaCl2溶液,有白色沉淀产生。2H++CO32-=CO2↑+H2OBa2++SO42-=BaSO4↓7、CO32-:加入H+,产生无色无味(排除SO32-离子的干扰)且能使澄清石灰水变混浊的气体。2H++CO32-=CO2↑+H2OCO2+Ca2++2OH-=CaCO3↓+H2O(三)定量实验——物质的量浓度溶液的配制1、物质的量浓度的配制所需的仪器:烧杯、容量瓶(要注明规格)、玻璃棒、胶头滴管、托盘天平、药匙、量筒。配制前要检查容量瓶是否漏水2、配制步骤:①.计算m=c×v×M②.称量③.溶解④.转移⑤.洗涤(2-3次洗涤液转入容量瓶)⑥.定容⑦.摇匀⑧.装瓶贴签3、仰视、俯视对溶液浓度有何影响?(1)俯视刻度线,实际加水量未到刻度线,使溶质的物质的量浓度增大;(2)仰视刻度线,实际加水量超过刻度线,使溶质的物质的量浓度减小。1/14津河中学学业水平复习资料4、容量瓶的使用六忌:(1)忌用容量瓶进行溶解(体积不准确)(2)忌直接往容量瓶倒液(洒到外面)(3)忌加水超过刻度线(浓度偏低)(4)忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高)(5)忌不洗涤玻璃棒和烧杯(浓度偏低)(6)忌标准液存放于容量瓶(容量瓶是量器,不是容器)(四)实验小常识1、仪器的使用(1)可以直接加热仪器有试管、坩埚、蒸发皿。必须垫石棉网加热的有烧杯、烧瓶。标明使用温度的仪器有:容量瓶、量筒。没有0刻度的量器有量筒。(2)选择仪器时要考虑仪器的量程。如量取3.0mL液体用10mL量筒,量取10.00mL液体用滴定管,配置100mL0.1000mol/L的氢氧化钠溶液用100mL容量瓶。(3)使用前必须检查是否漏水的仪器有:容量瓶、分液漏斗、滴定管。(4)试管上的油污可用热的氢氧化钠溶液(或热的纯碱溶液)洗。用其它试剂洗过后都必须用蒸馏水洗涤至既不聚集成滴又不成股流下。2、基本实验操作(5)药品的取用:Na、K保存于煤油中,用多的钠、钾、白磷必须放回原试剂瓶中。其他药品用多一般不回放。(6)沉淀是否沉淀完全、洗涤、洗净检验的一般方法:欲检验NaOH溶液中含有Na2CO3的量,在该此溶液中加入过量的氯化钡溶液,然后过滤、洗涤、干燥,称量所得沉淀的质量,经数据处理后即可得到。其中,检验所加试剂是否过量的操作是:静置后,取上层清液少许于试管中再滴加氯化钡溶液,若没有白色沉淀生成,则氯化钡过量。洗涤沉淀的操作是:向漏斗中加蒸馏水,至水面浸过沉淀物,待水滤出后,再重复2-3次。检验沉淀洗涤干浄的操作是:取最后的滤出液加入硝酸银,若没有沉淀产生,则洗涤干净。(7)试纸使用:用PH试纸测PH值时,试纸不湿...