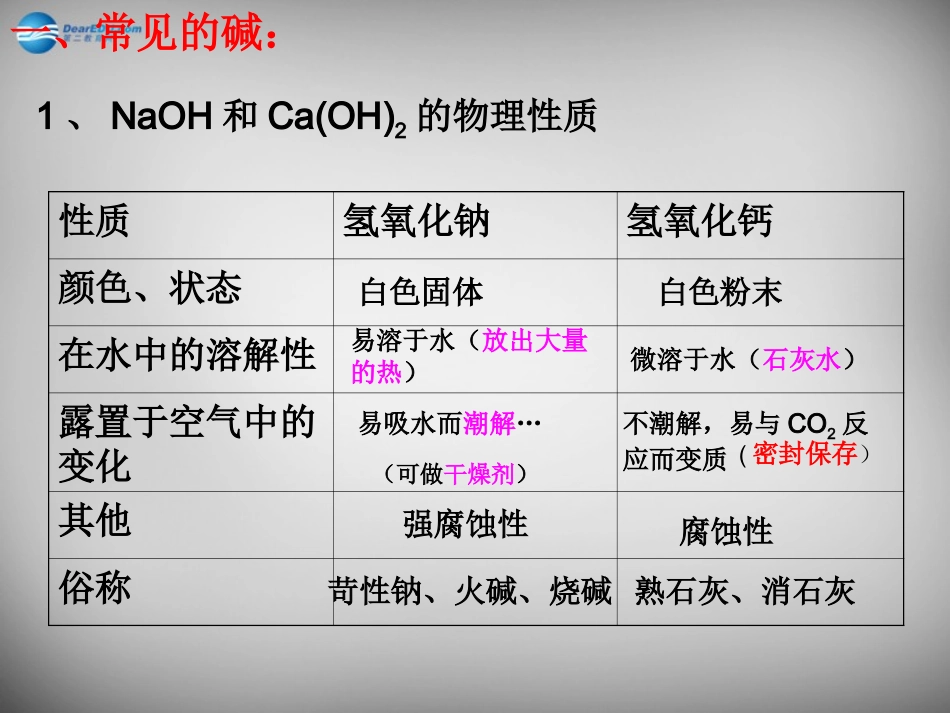
第二节碱及其性质常见的碱:二、碱的性质氢氧化钠氢氧化钙氢氧化钾氨水NaOHCa(OH)2KOHNH3·H2O性质氢氧化钠氢氧化钙颜色、状态在水中的溶解性露置于空气中的变化其他俗称微溶于水(石灰水)腐蚀性强腐蚀性易溶于水(放出大量的热)白色固体苛性钠、火碱、烧碱白色粉末熟石灰、消石灰易吸水而潮解…不潮解,易与CO2反应而变质一、常见的碱:1、NaOH和Ca(OH)2的物理性质(可做干燥剂)(密封保存)现象:剧烈反应,放出大量的热。CaCO3CaO+CO2↑高温生石灰熟石灰3.氧化钙(生石灰)的制法。2.Ca(OH)2的制法:CaO+H2O=Ca(OH)2注意:氧化钙(生石灰)可以做干燥剂思考:1、物质的分类2、哪些物质可做干燥剂?物质纯净物混合物单质化合物酸碱盐氧化物HCI、H2SO4、HNO3NaOH、Ca(OH)2、KOHNaCI、Na2SO4H2O、CO2干燥剂浓硫酸氢氧化钠固体氧化钙以上三种物质溶于水都放热,使溶液的温度升高。实验探究:碱的化学性质加入氢氧化钠溶液后的现象加入氢氧化钙溶液后的现象生锈铁钉氯化铜溶液碳酸钠溶液无现象无现象蓝色沉淀蓝色沉淀无现象白色沉淀反应的化学方程式:2NaOH+CuCl2=Cu(OH)2↓+2NaClCa(OH)2+CuCl2=Cu(OH)2↓+CaCl2Ca(OH)2+Na2CO3=2NaOH+CaCO3↓猜一猜:二氧化碳能与氢氧化钠反应吗?猜想:设计方案:方案1:向装满二氧化碳气体的塑料瓶中,倒入适量的氢氧化钠溶液振荡,若塑料瓶变瘪,说明反应了。方案2:取少量通入二氧化碳气体的氢氧化钠溶液,加入适量的稀盐酸,若有气泡生成,说明二氧化碳与氢氧化钠反应了。结论:二氧化碳与氢氧化钠(填“能”或“不能”)反应,反应的化学方程式为:。能CO2+2NaOH=Na2CO3+H2O注:常用氢氧化钠的浓溶液吸收二氧化碳气体。1.碱溶液可以使紫色的石蕊变蓝,无色的酚酞变红;2.碱可以与某些盐反应生成新碱和新盐;3.碱可以与某些非金属氧化物反应生成盐和水。CO2+Ca(OH)2=CaCO3↓+H2O注:不溶于水的碱不能使酸碱指示剂变色。注:可用来检验二氧化碳气体。二、碱的化学性质2NaOH+CuCl2=2NaCl+Cu(OH)2蓝色沉淀想一想:碱溶液为什么具有相似的化学性质?NaOH=Na++OH-Ca(OH)2=Ca2++2OH-NH3.H2O=NH4++OH-在碱溶液中,都含有相同的氢氧根离子(OH-),因此它们具有相似的化学性质。1.实验桌上有两瓶未贴标签的溶液,只知道它们是氢氧化钠溶液和氢氧化钙溶液,你有哪些方法可以把它们鉴别出来?方案一:取样,分别加入适量的碳酸钠溶液,有白色沉淀生成的是氢氧化钙溶液,无明显现象的是氢氧化钠溶液。方案二:通二氧化碳2.长期放置的氢氧化钠溶液往往含有杂质。(1)含杂质的原因是:,反应的化学方程式为:;(2)验证方法:反应的化学方程式为:;(3)除去杂质的方法:反应的化学方程式为:。氢氧化钠吸收了空气中的二氧化碳Ca(OH)2+Na2CO3=2NaOH+CaCO3↓2NaOH+CO2=Na2CO3+H2O取少量氢氧化钠溶液加入足量的稀盐酸,若有气泡产生,说明变质了。Na2CO3+2HCl=2NaCl+CO2↑+H2O向氢氧化钠溶液中逐滴加入氢氧化钙溶液,至不再产生沉淀时为止。1.氢氧化钠应该怎样保存?学以致用:氢氧化钠在空气中不仅易,还能和空气中的起反应,所以氢氧化钠必须保存。潮解二氧化碳密封2.有人用石灰乳刷墙,并在室内烧一个炭盆,开始墙面变得潮湿,过几天墙壁就变得又硬又白了。在这个过程发生了哪些化学变化?写出有关的化学方程式。CO2+Ca(OH)2=CaCO3↓+H2OC+O2CO2点燃3、氢氧化钠不能干燥哪些气体?CO2、SO2、HCl造纸氢氧化钠的用途纺织清洁剂建筑材料工业上制烧碱改良酸性土壤处理工厂废水3、下列关于碱的性质的叙述中,错误的是()A、碱溶液中滴入紫色石蕊试液变蓝色。B、非金属氧化物都能跟碱反应生成盐和水。C、非金属氧化物能跟碱反应生成盐和水,但不是中和反应。D、碱溶液只能跟某些盐发生反应。2、硫酸铜溶液中加入少量的氢氧化钠溶液,立即生成()A.红褐色沉淀B.蓝色沉淀C.绿色沉淀D.白色沉淀1.下列关于碱的叙述正确的是()A.能电离生成氢氧根离子的化合物C.能跟酸发生中和反应的化合物D.水溶液PH大于7的化合物B.能使紫色石蕊试液变蓝的溶液CBB4.为了鉴别氢氧化钠、水、稀硫酸三种无色溶液,最简单的方法是分别各取少量的液体,滴入()A、碳酸钠溶液B、紫色石蕊试液C、氯化钡溶液D、无色酚酞试液5.下列气体其中能用氢氧化钠干燥的是()A、CO2B、O2C、SO3D、HClBB谢谢大家!谢谢大家!