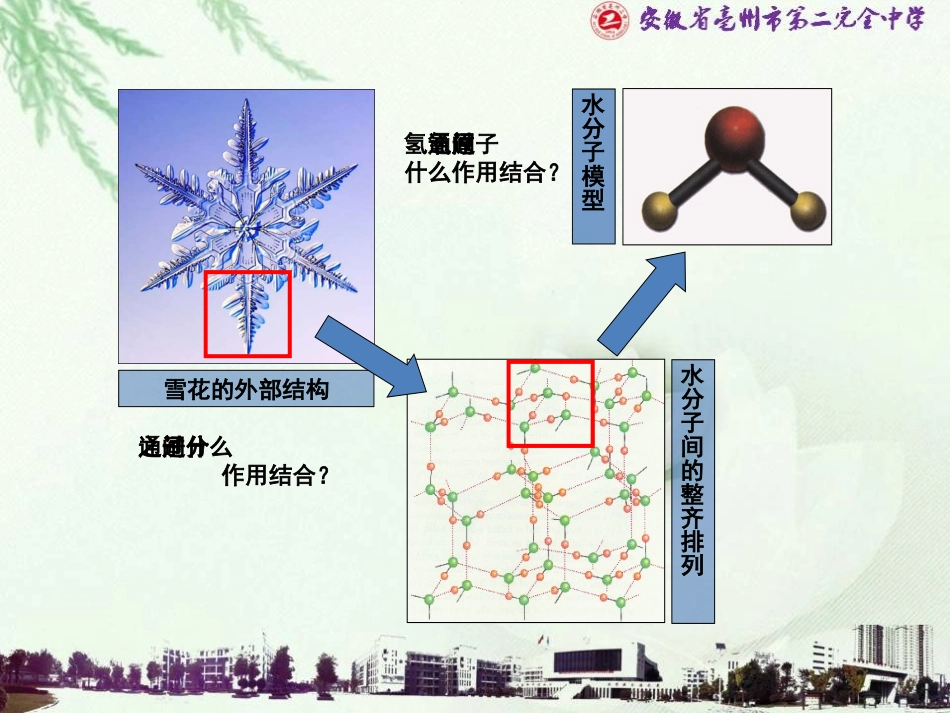
亳州第二完全中学徐金刚雪花的外部结构水分子间的整齐排列水分子模型分子之间通过什么作用结合?氢氧原子间通过什么作用结合?【复习回顾】1.有下列物质:N2、CaO、He、CH4、Na2S、NaOH、NaHCO3(1)其中只含有共价键的是___________(2)只含有离子键的是__________(3)既含有共价键又含有离子键的是__________(4)属于共价化合物的是___________(5)属于离子化合物的是_____________N2、CH4CaO、Na2SNaOH、NaHCO3CH4CaO、Na2S、NaOH、NaHCO3我们在第一章中学习了电子云和原子轨道理论之后,如何进一步理解H2、HCl、Cl2中的共价键呢?学习目标1.认识共价键的形成和实质。2.知道共价键的主要类型σ键和π键。3.说出σ键和π键的明显差别和一般规律。【问题探究】以H2的形成为例探究共价键的形成及本质1.氢原子的价电子构型如何?2.氢分子的形成过程原子轨道有什么变化?3.核外电子的运动情况有什么变化?4.氢原子的能量有什么变化?vr0V:势能r:核间距两个核外电子自旋方向相反的氢原子靠近r0vr0r0V:势能r:核间距r0vr0r0V:势能r:核间距r0vr0r0V:势能r:核间距H2中的化学键,可以认为是电子自旋相反成对,结果使体系的能量降低r0=0.074nmvr0V:势能r:核间距两个核外电子自旋方向相同的氢原子靠近成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,电子在两原子核之间出现的概率增加,受到两个原子核的吸引,导致体系的能量降低,形成化学键。(1)共价键的形成及本质高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用是共价键的本质。包括吸引和排斥,当吸引和排斥达到平衡时即形成了稳定的共价键以HCl、H2O、Cl2为例描述共价键的形成过程并完成下列问题元素的电负性差别价电子排布是否有单电子HClHClH2OHOCl2Cl1S11S13S3P252S2P240.91.40重叠重叠重叠原子轨道是否重叠有有有3S3P25讨论:共价键的形成条件是什么?电负性:O:3.5Cl:3.0H:2.1Na:0.9①电负性相同或相差很小的非金属元素原子之间形成共价键。②一般成键原子有未成对电子(自旋相反)。③成键原子的原子轨道在空间重叠。(2)共价键的形成条件拓展思考:任何气体单质中都存在共价键吗?如:H2、O2、Cl2、N2、HCl、H2O、NH3、CH4、CO2、等原子之间都形成共价键。另外,NaOH、Na2CO3等物质中也存在共价键。HHHHσ键用电子云表示共价键的形成1.H2的形成过程S-SHClH-ClClClClCl2、HCl分子的形成过程S-P3、Cl2分子的形成过程P-P科学探究NNN2分子中三条键的成键方式分别是什么?2S2P23N原子的价电子排布式:p-pπ键的形成N2中p-pσ键和p-pπ键的形成过程NN电子云重叠时优先形成σ键,且任何两个原子之间只能形成一个σ键。【小结】σ键的成键特点:①沿键轴(两核的连线)方向“头碰头”重叠成键②σ键可以沿键轴旋转;③σ键较稳定,存在于一切共价键中。因而,只含有σ键的化合物性质是比较稳定的(烷烃)。2、σ键与π键(1)σ键:原子轨道以“头碰头”方式相互重叠导致电子在核间出现的概率增大而形成的共价键。按电子云重叠方式分类【小结】π键的成键特点:①“肩并肩”重叠成键;呈镜像对称。②电子云重叠程度不及σ键大,较活泼;③π键必须与σ键共存;④π键不能自由旋转。(2)π键:原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的概率增大而形成的共价键。乙烷、乙烯、乙炔分子中的共价键分别是由几个σ键和几个π键组成。科学探究乙烷:个σ键乙烯:个σ键个π键乙炔:个σ键个π键75132σ键π键特征项目键型σ键与π键的对比“头碰头”“肩并肩”轴对称镜面对称σ键强度大不容易断裂π键强度较小容易断裂共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键小结成键方式牢固程度成键判断规律H2HCl特征组成原子吸引共用电子对的能力共用电子对的位置成键原子的电性结论同种元素原子不同种元素原子相同不相同不偏向任何一个原子偏向吸引电子能力强的原子不显电性显电性键无极性键有极性讨论:H2、HCl分子中共用电子对与原子的位置关系及原子的电性情况非极性键——共用电子对不偏向任何原子的共价键。同种非金属元素的...