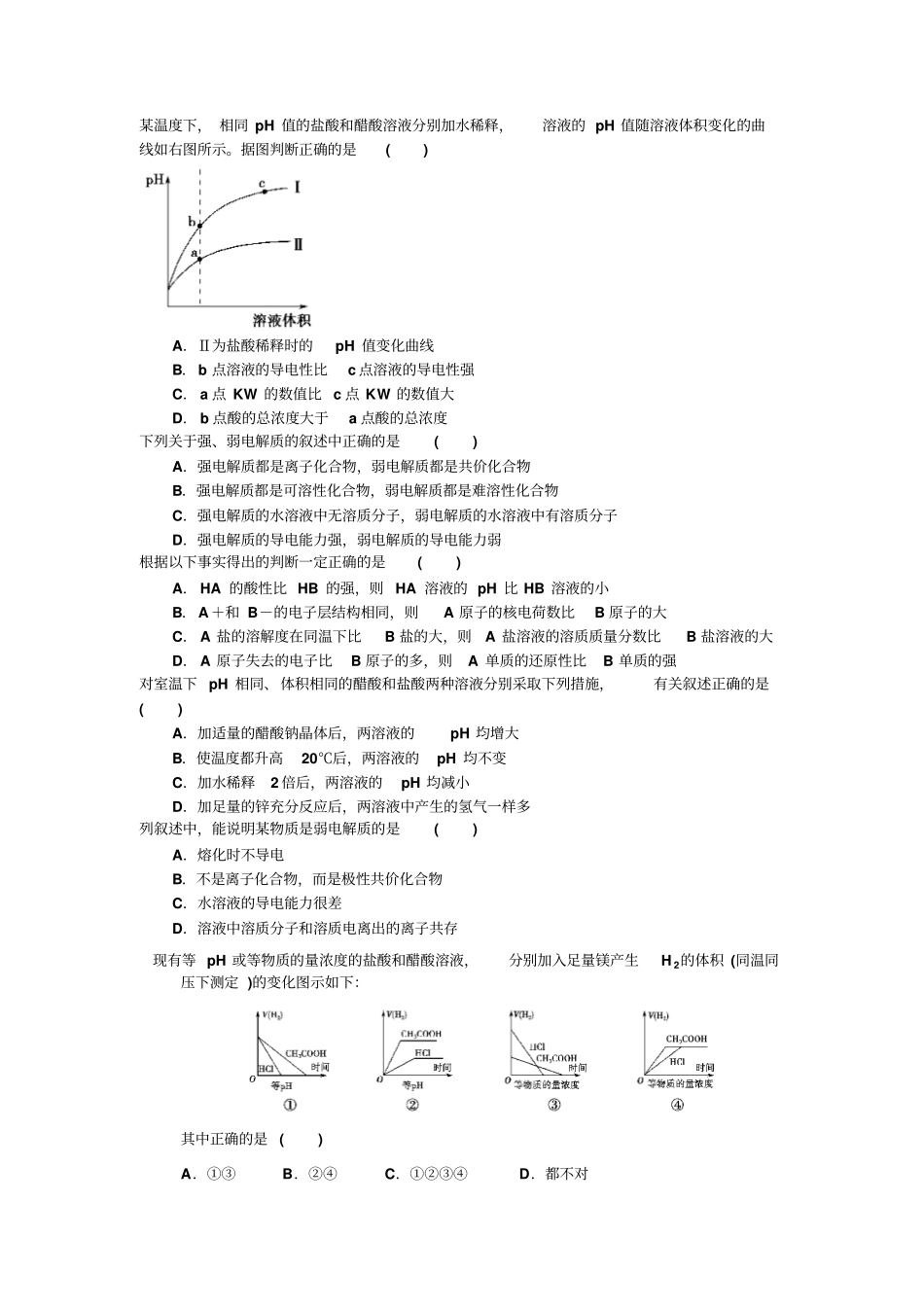
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,溶液的pH值随溶液体积变化的曲线如右图所示。据图判断正确的是()A.Ⅱ为盐酸稀释时的pH值变化曲线B.b点溶液的导电性比c点溶液的导电性强C.a点KW的数值比c点KW的数值大D.b点酸的总浓度大于a点酸的总浓度下列关于强、弱电解质的叙述中正确的是()A.强电解质都是离子化合物,弱电解质都是共价化合物B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子D.强电解质的导电能力强,弱电解质的导电能力弱根据以下事实得出的判断一定正确的是()A.HA的酸性比HB的强,则HA溶液的pH比HB溶液的小B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是()A.加适量的醋酸钠晶体后,两溶液的pH均增大B.使温度都升高20℃后,两溶液的pH均不变C.加水稀释2倍后,两溶液的pH均减小D.加足量的锌充分反应后,两溶液中产生的氢气一样多列叙述中,能说明某物质是弱电解质的是()A.熔化时不导电B.不是离子化合物,而是极性共价化合物C.水溶液的导电能力很差D.溶液中溶质分子和溶质电离出的离子共存现有等pH或等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁产生H2的体积(同温同压下测定)的变化图示如下:其中正确的是()A.①③B.②④C.①②③④D.都不对下列关于盐酸与醋酸两种稀溶液的说法正确的是()A.相同浓度的两溶液中c(H+)相同B.100mL0.1mol·L-1的两溶液能中和等物质的量的氢氧化钠C.pH=3的两溶液稀释100倍,pH都为5D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是()A.该溶液的pH=4B.升高温度,溶液的pH增大C.此酸的电离平衡常数约为1×10-7D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O===HA+NaHCO32NaB+CO2+H2O===2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是()A.HA较强B.HB较强C.两者一样D.无法比较下列说法正确的是()A.强电解质溶液一定比弱电解质溶液的导电性强B.强电解质的稀溶液中不存在溶质分子C.强电解质都是离子化合物,而弱电解质都是共价化合物D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同把0.05molNaOH固体分别加入到下列100mL溶液中,导电能力变化较大的是()A.0.5mol/LMgSO4溶液B.0.5mol/L盐酸C.0.5mol/L的CH3COOH溶液D.0.5mol/LNH4Cl溶液醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。该同学设计了如下方案,其中错误的是()A.先配制一定量的0.10mol/LCH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质B.先配制一定量0.01mol/L和0.10mol/L的CH3COOH溶液,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质C.先测0.10mol/LCH3COOH溶液的pH,然后将其加热至100℃,再测pH,如果pH变小,则可证明醋酸是弱电解质D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质冰醋酸加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是()向1LpH=2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则下图中比较符合客观事实的是()相同温度下,两种氨水A、B,浓度分别是0.2mol/L和0.1mol/L,则A和B的OH-浓度之比()A.大于2B.小于2C.等于2D.不能确定电离度是描述弱电解质电离程度的物理量,电离度=(已电离的物质的量/原来的总物质的量)×100%。现取20mLpH=3的CH3COOH溶液,加入0.2mol·L-1的氨水,测得溶液导电性变化如右图,则加入氨水前CH3COOH的电离度为()A.0.5%B.1.5%C.0.1%D.1%解析:从所给的公式可以看出,欲求电离度...