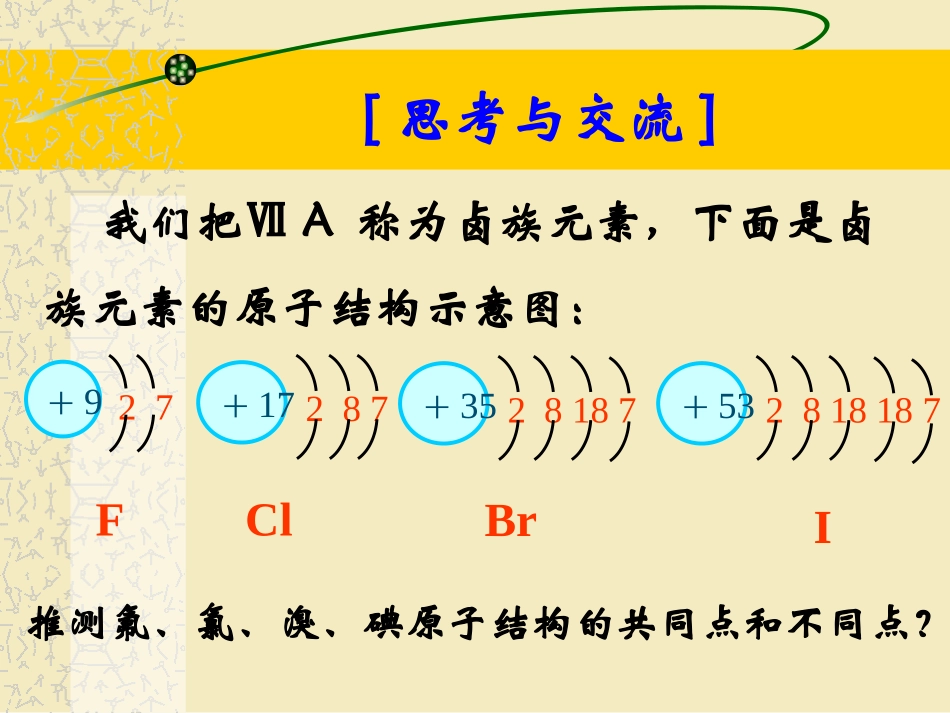
化学Ⅱ第一节元素周期表第一章物质结构元素周期律第三课时卤族元素[思考与交流]推测氟、氯、溴、碘原子结构的共同点和不同点?我们把ⅦA称为卤族元素,下面是卤族元素的原子结构示意图:+927+17287+3528187+532818187FClBrI最外层电子数均为,均易电子,具有强性。一、卤素原子结构特点随着核电荷数的递增,电子层数逐渐,原子半径逐渐。(1)相似性:(2)递变性:7得到氧化增多增大二、卤素单质的物理性质(1)相似性:(2)递变性:有颜色,密度小,熔沸点都较低。阅读教材P8:资料卡片颜色:状态:密度:熔沸点:逐渐加深气→液→固逐渐增大依次增高三、卤素单质与H2的反应名称反应条件方程式氢化物稳定性F2Cl2Br2I2冷暗处爆炸H2+F2=2HFHF很稳定光照或点燃H2+Cl2=2HClHCl较稳定加热H2+Br2=2HBrHBr不如HCl稳定不断加热,缓慢进行H2+I22HIHI很不稳定三、卤素单质与H2的反应F2Cl2Br2I2反应越来越难HF>HCl>HBr>HI与H2剧烈程度:生成的氢化物的稳定性:水溶液酸性:HF<HCl<HBr<HI四、卤素单质之间的置换反应实验操作实验现象化学方程式将少量氯水加入NaBr溶液中,用力振荡后加少量CCl4,振荡,静置静置后,液体分层,上层,下层。将少量氯水加入KI溶液中,用力振荡后加少量CCl4,振荡,静置静置后,液体分层,上层,下层。将少量溴水加入KI溶液中,用力振荡后加少量CCl4,振荡,静置静置后,液体分层,上层,下层。无色橙红色无色紫红色无色紫红色2NaBr+Cl2=2NaCl+Br22KI+Cl2=2KCl+I22KI+Br2=2KBr+I2由上述反应可比较卤素单质____性强弱。氧化氧化性:F2>Cl2>Br2>I2★从F→I,元素的非金属性逐渐减弱。相应卤素离子的还原性由强到弱的顺序是:I->Br->Cl->F-四、卤素单质之间的置换反应五、卤素单质与水的反应2F2+2H2O=4HF+O2(剧烈反应)逐渐困难通式:X2+H2O=HX+HXO(X=Cl、Br、I但≠F)I2+H2O=HI+HIOBr2+H2O=HBr+HBrOCl2+H2O=HCl+HClO六、卤素单质与金属的反应3X2+2Fe==2FeX3△△I2+Fe==FeI2(X=F、Cl、Br但≠I)卤素单质与变价金属(如Fe)反应时,F2、Cl2、Br2生成高价卤化物(如FeX3),而I2只能生成低价卤化物(如FeI2)总结卤素的递变规律卤族元素周期表从上到下(F、Cl、Br、I),随着核电荷数的增加,元素原子的电子层数逐渐,原子半径逐渐,原子核对最外层电子的引力逐渐,原子得电子能力逐渐,与氢气越来越反应,生成氢化物越来越。元素的非金属性逐渐,增多增大减弱减弱减弱难不稳定七、元素非金属性强弱判断依据(1)非金属单质与氢气化合的难易程度;比较元素非金属性强弱,其实质是看元素原子得电子的难易,越容易得电子,非金属性越强,反之非金属性越弱。(2)形成气态氢化物的稳定性;氢化物稳定性越强,非金属性越强;(3)单质间的置换反应。通过碱金属及卤族元素原子结构及其单质性质学习可以得出:原子的结构决定了元素的性质,同主族元素从上到下,元素的性逐渐增强,性逐渐减弱。同主族元素其单质和化合物的性质既具有相似性,又具有递变性。总结金属非金属随堂训练1.随着卤素原子半径的增大,下列递变规律正确的是()A单质的熔沸点逐渐降低B卤素离子的还原性逐渐增强C气态氢化物稳定性逐渐增强D单质氧化性逐渐增强B2、砹是原子序数最大的卤族元素,根据卤族性质的递变规律,对砹及其化合物的叙述,正确的是()A、与H2化合能力:At2>I2B、砹在常温下为白色固体;C、砹原子的最外电子层上有7个电子;D、AgAt易溶于水。C随堂训练