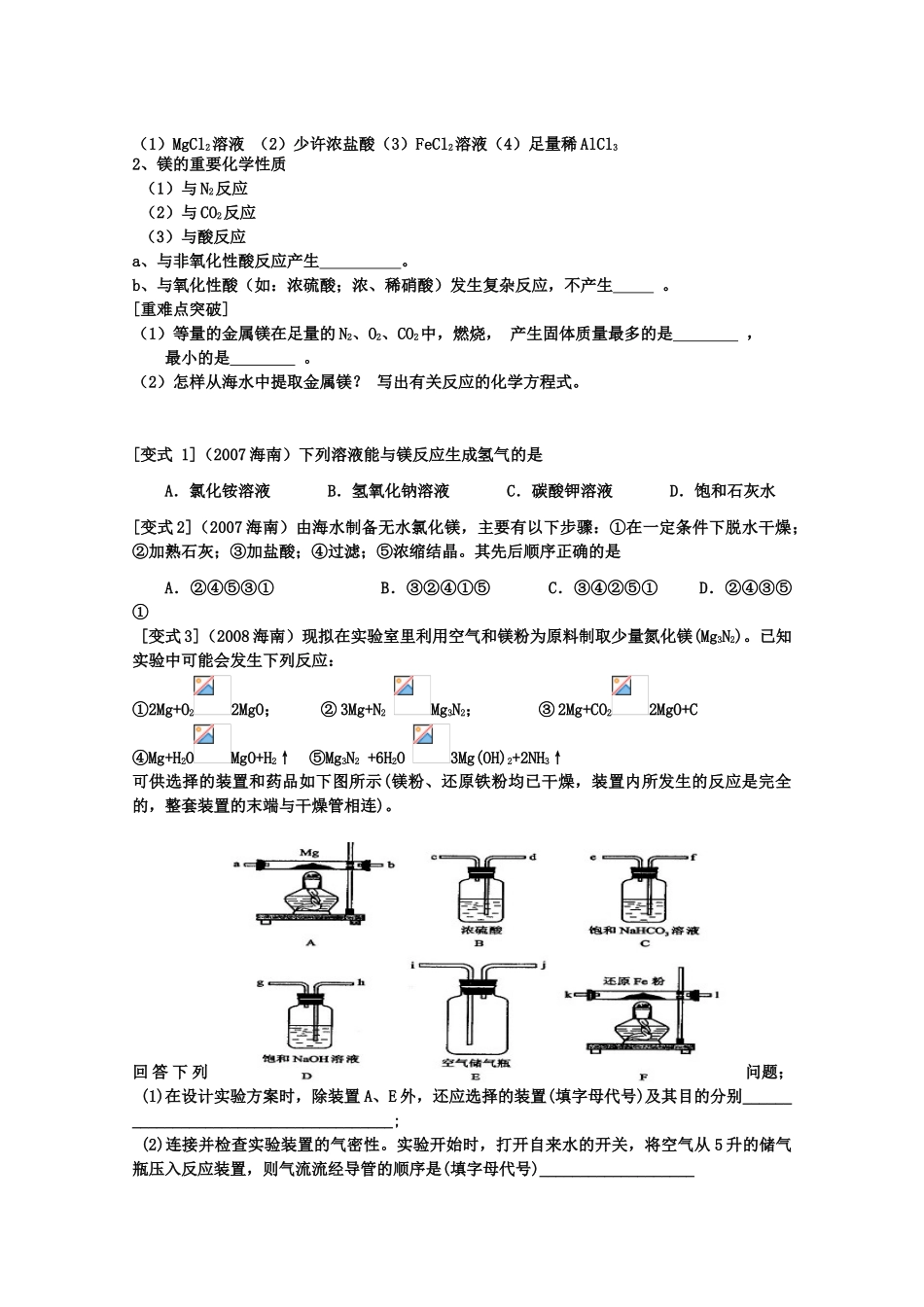
一、内蒙古乌拉特中旗一中高三化学《金属的性质》学案二、三、金属的通性位置:金属元素位于周期表的,最外层电子数大部分少于物理通性:化学性质:易电子,被,金属表现性四、钠、镁、铝、铁、铜的原子结构示意图及在周期表中的位置三、金属活动顺序表金属活动顺序表KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu金属原子的还原性金属阳离子的氧化性与氧气化合与水反应置换与非氧化性酸(如盐酸、稀硫酸等)与氧化性酸(如硝酸、浓硫酸等)与盐溶液反应自然界中的存在形式金属冶炼五、钠、铝、铁、单质的重要性质(写方程式,是离子反应的写离子方程式)金属化学性质NaAlFe与O2反应与H2O反应与酸反应与盐反应与碱反应金属活泼性四、几种常见金属的重要化学特性1、钠的性质(1)钠在物理性质方面不同于镁、铝等金属的有:,原因是:_________________。(2)钠的重要化学性质a、与氧气反应b、与水反应现象:c、与酸溶液反应(实质)钠与酸溶液反应比钠与水更加,会发生。d、与盐溶液反应①与氯化铵溶液反应②投入硫酸铜溶液中。(3)钠的保存和取用钠通常保存在中,目的是。(4)钠的应用与制备①钠可用于冶炼锆、钛等金属是因为;Na—K(含钾50-80%)合金作原子反应堆的导热剂是因为;②工业上冶炼钠的方法是,化学方程式。[重难点突破](1)取一支大试管,加入15mL蒸馏水,在加入5mL苯(d=0.87g/cm-3),静置,取黄豆大小的金属钠(d=0.97g/cm-3),轻轻放入这支试管中,试推测能观察到的现象是(2)在实验室里常把钠浸在煤油中保存,要取用金属钠进行上述实验,取用的操作方法是____[变式1](2007全国理综Ⅱ)在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是A.Na2OB.Na2O2C.Na2O和Na2O2D.Na2O2和NaO2[变式2]将一小块钠分别投入下列溶液中,指明现象写出有关反应的化学方程式(1)MgCl2溶液(2)少许浓盐酸(3)FeCl2溶液(4)足量稀AlCl32、镁的重要化学性质(1)与N2反应(2)与CO2反应(3)与酸反应a、与非氧化性酸反应产生。b、与氧化性酸(如:浓硫酸;浓、稀硝酸)发生复杂反应,不产生。[重难点突破](1)等量的金属镁在足量的N2、O2、CO2中,燃烧,产生固体质量最多的是,最小的是。(2)怎样从海水中提取金属镁?写出有关反应的化学方程式。[变式1](2007海南)下列溶液能与镁反应生成氢气的是A.氯化铵溶液B.氢氧化钠溶液C.碳酸钾溶液D.饱和石灰水[变式2](2007海南)由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是A.②④⑤③①B.③②④①⑤C.③④②⑤①D.②④③⑤①[变式3](2008海南)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:①2Mg+O22MgO;②3Mg+N2Mg3N2;③2Mg+CO22MgO+C④Mg+H2OMgO+H2↑⑤Mg3N2+6H2O3Mg(OH)2+2NH3↑可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题;(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别______________________________________;(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___________________(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?__________,原因是____________________;(4)请设计一个实验,验证产物是氮化镁:__________________________________________________________________3、铝的重要化学性质(1)空气中铝制品稳定的原因:常温下,铝遇到酸,由于而钝化,所以通常用铝槽车运输。(2)既与反应又与反应,体现了铝既具有性,又具有性(3)铝热反应铝热剂是指。Al在高温条件能与某些金属氧化物(如______)发生铝热反应。举例:(反应方程式)现象,在生产中应用。[重难点突破](1)高大建筑物的在定向爆破时需借助于一种化学试剂,这种化学试剂是什么?;应用:。(2)为什...