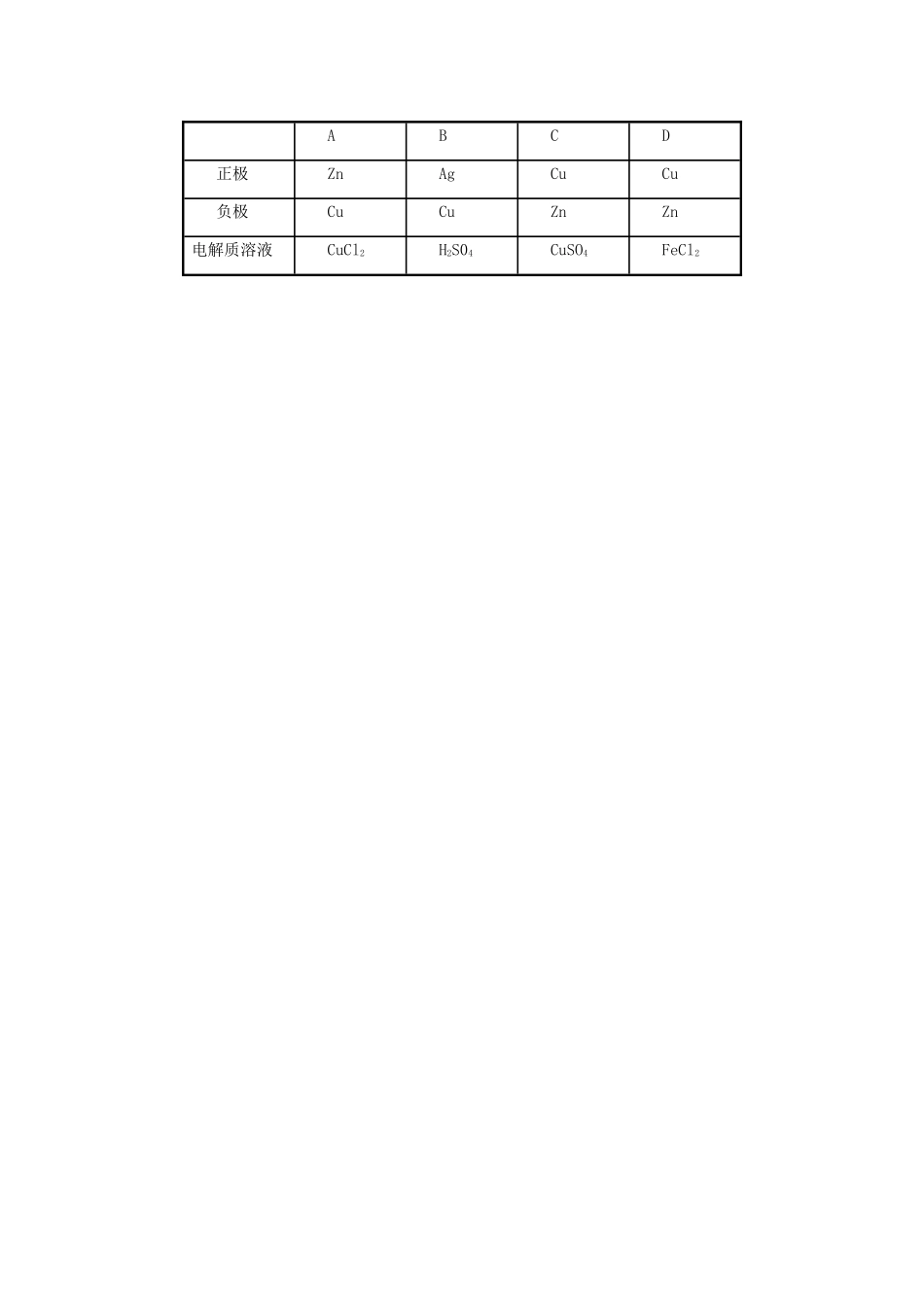
高一化学《化学能转化为电能》学案新人教版班级姓名一、【目标诠释】——我来认识通过实验探究认识化学能可以转化为电能,弄清原电池的工作原理,重点是理解原电池的形成条件及正负极的判断方法,能书写简单原电池的电极反应式。二、【导学菜单】——我来预习1.能源是人类赖以生存的重要条件,你能说出生活中常用到的能源吗?2.请思考生活中有哪些供电方式?3.物理学已学过电流,请问电流是如何产生的呢?化学反应可以分为氧化还原反应和非氧化还原反应,分类的依据是什么?氧化还原反应的实质是什么?想一想,你能得到什么启示?4.什么是原电池?原电池的工作原理是什么?它是如何将化学能转化成电能的?5.物理学上是怎样定义原电池的正负极的?如何判断原电池的正负极?在原电池中电子流动方向怎样?电流方向呢?阳离子是向哪极移动的?你能写出正负极发生反应的电极方程式吗?6.请思考构成原电池的条件有哪些?三、【困惑扫描】——我来质疑四、【感悟平台】——我来探究探究一:原电池的工作原理探究二:原电池的形成条件稀硫酸稀硫酸稀硫酸蔗糖ZnCuZnGZnCuGZnCu请问:①各池中锌片和铜片上分别有什么现象?为什么?②在原电池反应过程中是如何产生电流的?③形成原电池的条件是什么?五、【过关窗口】——我来练习1、下列6个装置中,能发生原电池反应的是();若能构成原电池,请判定出原电池正负极,并写出对应的电极反应式和总反应方程式。2、下列说法中正确的是()A、原电池是把电能转为化学能的装置B、原电池中电子流出的一极是正极,发生氧化反应C、原电池两级均发生氧化还原反应D、原电池中的阳离子向正极移动3、已知空气-锌电池的电极反应为:锌粒:Zn+2OH——2e—=ZnO+H2O石墨:O2+H2+2e—=2OH—。根据判断,锌片是()A、正极,并被还原B、正极,并被氧化C、负极,并被还原D、负极,并被氧化4、把A、B、C、D4块金属片浸入稀硫酸中,用导线两两相连组成原电池。若A、B相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,电子由D经导线流向B。则此4种金属的活动性由强到弱的顺序为()A、A>B>C>DB、A>C>D>BC、C>A>B>DD、B>A>C>D5、为防止船体腐蚀,通常在船壳水线以下位置镶嵌一定数量的()A、铜块B、铅块C、锌块D、铁块6、实验室欲快速制氢气,最好的方法采用()A、粗锌加浓硫酸B、纯锌加稀盐酸C、粗锌加稀硫酸D、粗锌加稀硝酸7、原电池的总反应的方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是()ABCD正极ZnAgCuCu负极CuCuZnZn电解质溶液CuCl2H2S04CuSO4FeCl2