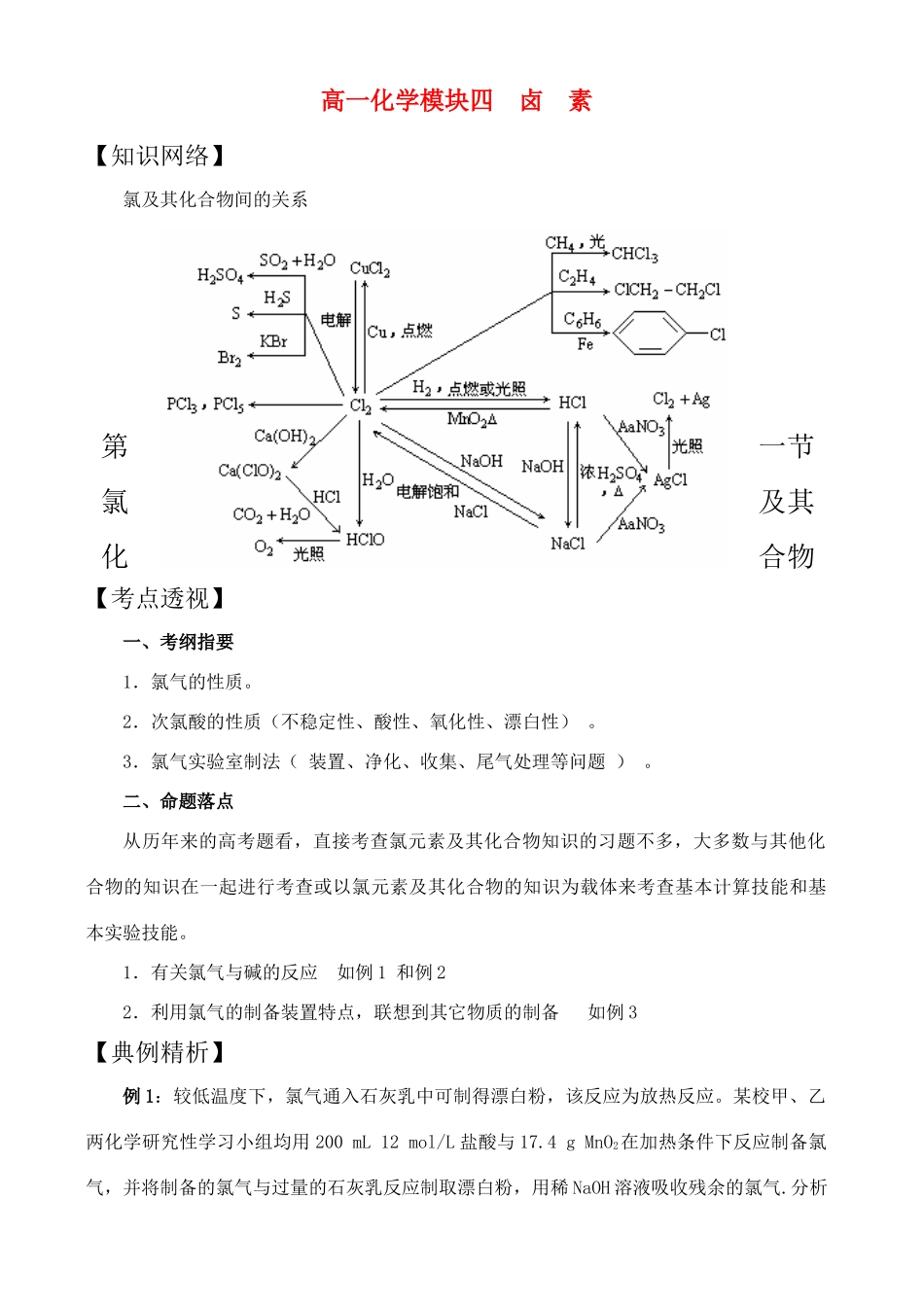
高一化学模块四卤素【知识网络】氯及其化合物间的关系第一节氯及其化合物【考点透视】一、考纲指要1.氯气的性质。2.次氯酸的性质(不稳定性、酸性、氧化性、漂白性)。3.氯气实验室制法(装置、净化、收集、尾气处理等问题)。二、命题落点从历年来的高考题看,直接考查氯元素及其化合物知识的习题不多,大多数与其他化合物的知识在一起进行考查或以氯元素及其化合物的知识为载体来考查基本计算技能和基本实验技能。1.有关氯气与碱的反应如例1和例22.利用氯气的制备装置特点,联想到其它物质的制备如例3【典例精析】例1:较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200mL12mol/L盐酸与17.4gMnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀NaOH溶液吸收残余的氯气.分析实验结果发现:①甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值,②甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。试回答下列问题:(1)上述实验中理论上最多可制得Ca(ClO)2多少克?(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。解析:(1)根据题意n(HCl)=12mol/L×0.2L=2.4moln(MnO2)=17.4g÷87g/mol=0.2molMnO2+4HCl(浓)△MnCl2+Cl2↑+2H2On(MnO2)∶n(HCl)=2.4mol∶0.2mol=12∶1>4∶1所以浓HCl过量,应根据MnO2计算。根据制备氯气的化学方程式n(Cl\2)=n(MnO2)=0.2mol又因为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2On[Ca(ClO)2]=1/2n(Cl2)=1/2×0.2mol=0.1molm[Ca(ClO)2]=143g/mol×0.1mol=14.3g(2)①随着反应进行,温度升高,会产生副产物Ca(ClO3)2;6Cl2+6Ca(OH)2△5CaCl2+Ca(ClO3)2+6H2O②Cl2未与石灰乳完全反应,残余Cl2被NaOH溶液吸收Cl2+2NaOH=NaCl+NaClO+H2O答案:见解析例2:某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO-3的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为()A.21:5B.11:3C.3:1D.4:1解析:根据Cl2通入NaOH溶液中所发生两个反应Cl2+2NaOH=NaCl+NaClO+H2O3Cl2+6NaOH=5NaCl+NaClO3+3H2O从ClO-与ClO-3的浓度之比为1:3,利用电子得失数目相同,不难推出Cl2与NaOH溶液反应时被还原氯元素与被氧化氯元素的物质的量之比为4:1答案:D例3:将KMnO4与KClO3的混合物加热可得气体A,在反应后的残留固体中加入一定量的浓H2SO4并加热,又可得到单质气体B。写出有关化学方程式。解析:此题是两种制气体实验的结合,以上两种钾盐是制取O2的主要药品,由于KMnO4分解时有O2和MnO2、K2MnO4产生,产物中MnO2正好做KClO3制O2的催化剂,当加入一定量的浓H2SO4并加热时,其中的KCl、MnO2与浓H2SO4产生单质Cl2。答案:O2Cl2【常见误区】1.氯气与铁反应的价态很容易当成+2价,要注意铁与盐酸反应时产物的比较2.由于氯气不能与氧气直接化合,所以有人认为就无氯的氧化物存在,而ClO2就是一种常用的消毒剂。3.要注意氯化铜溶液的颜色与其浓度有关,不能就认为是蓝色。4.干燥的氯化氢的性质很稳定,不能使石蕊试纸变红,所以试纸在使用前一定要润湿。5.有关X-的检验,要特别注意SiO32-的干扰。【基础演练】1.世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。则二氧化氯()A.是强氧化剂B.是强还原剂C.是离子化合物D.分子中氯为-1价2.为防止贮存液氯的钢瓶被腐蚀,装氯气之前钢瓶必须()A.充入稀有气体B.除去铁锈C.彻底干燥D.放入铁粉3.氯水的漂白作用是通过()A.中和作用B.氧化作用C.漂白粉分解D.还原作用4.漂白粉在空气中容易失效的原因是()A.次氯酸不稳定,易分解B.氯化钙易潮解C.Ca(ClO)2易与盐酸反应D.Ca(ClO)2易与空气中的CO2和H2O反应5.已知KMnO4与浓HCl在常温下反应能产生Cl2。若用图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表...