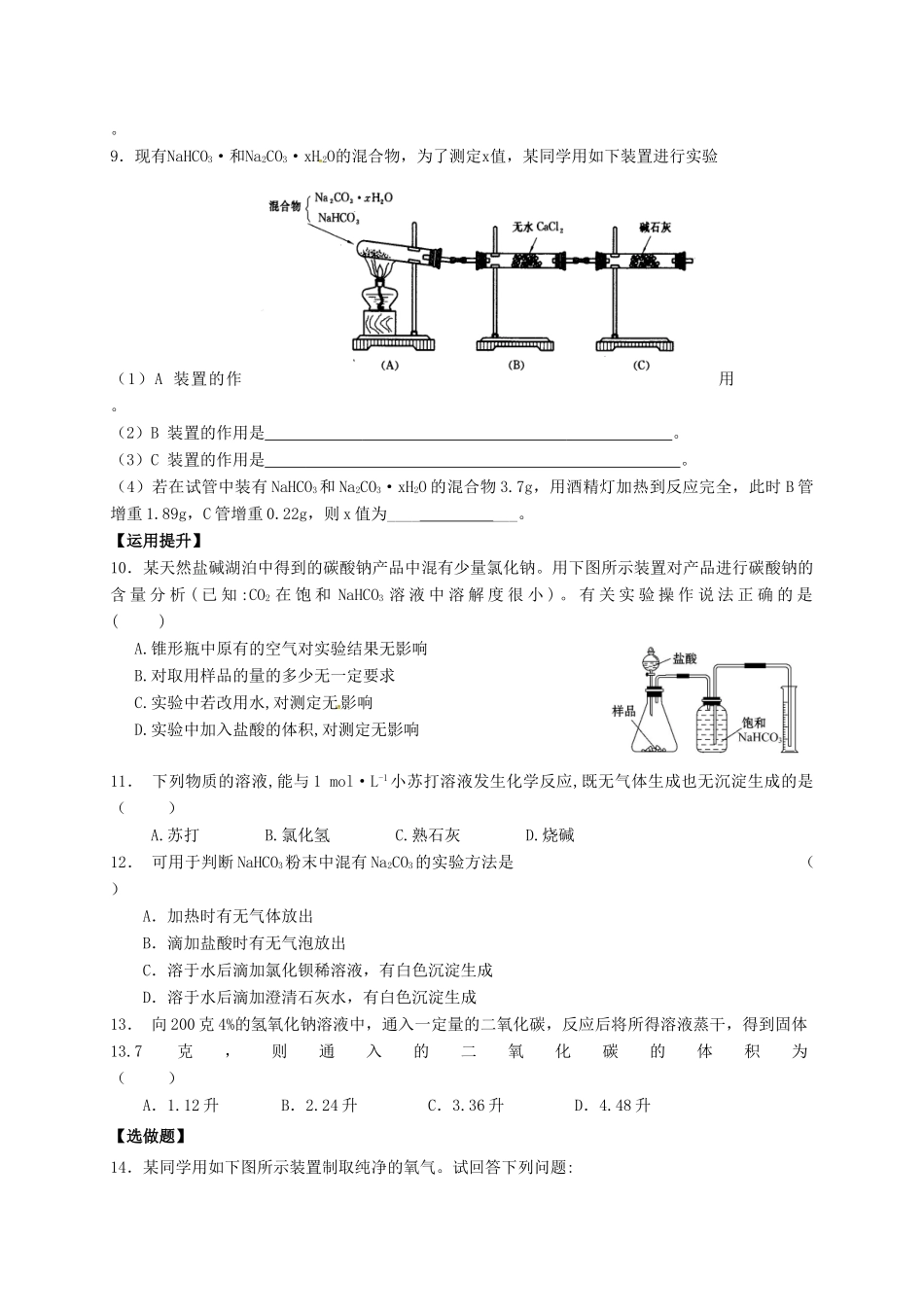
课时6碳酸钠的性质与应用【基础梳理】1.在食品加工或餐饮业中使用量特别要注意严加控制的物质是()A.氯化钠B.谷氨酸钠(味精)C.碳酸氢钠D.亚硝酸钠2.为使以面粉为原料的面包松软可口,通常用NaHCO3作发泡剂,因为它()①热稳定性差②增加甜味③产生二氧化碳气体④提供钠离子A.②③B.①③C.①④D.③④3.下列有关Na2CO3和NaHCO3的说法中正确的是()A.两者溶液均为碱性,在医疗上均可用于治疗胃酸过多B.它们都易溶于水C.在通常状况下,受热都易分D.都可以和NaOH溶液反应4.下列物质中不能与CO2反应的是()A.Na2O2固体B.Na2CO3溶液C.Ca(ClO)2溶液D.BaCl2溶液5.往饱和碳酸钠溶液中加入或通入少量下列物质能反应,但看不到明显现象的是()A.Ca(OH)2溶液B.Na2O2固体C.HCl溶液D.CO26.碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为()A.3.38gB.4.58gC.4.16gD.4.41g7.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是()A.Na2CO3B.Na2O2、Na2CO3C.NaOH、Na2CO3D.Na2O2、NaOH、Na2CO38.为除去下列物质中少量的杂质(括号内),请写出所加的试剂或操作,并写出相应的化学方程式:(1)Na2CO3固体(NaHCO3):____________,。(2)NaHCO3溶液(Na2CO3):____________,。(3)NaCl溶液中混有少量Na2CO3:___________,。(4)NaOH溶液中混有少量Na2CO3:____________,。9.现有NaHCO3·和Na2CO3·xH2O的混合物,为了测定x值,某同学用如下装置进行实验(1)A装置的作用是。(2)B装置的作用是。(3)C装置的作用是。(4)若在试管中装有NaHCO3和Na2CO3·xH2O的混合物3.7g,用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22g,则x值为_______。【运用提升】10.某天然盐碱湖泊中得到的碳酸钠产品中混有少量氯化钠。用下图所示装置对产品进行碳酸钠的含量分析(已知:CO2在饱和NaHCO3溶液中溶解度很小)。有关实验操作说法正确的是()A.锥形瓶中原有的空气对实验结果无影响B.对取用样品的量的多少无一定要求C.实验中若改用水,对测定无影响D.实验中加入盐酸的体积,对测定无影响11.下列物质的溶液,能与1mol·L-1小苏打溶液发生化学反应,既无气体生成也无沉淀生成的是()A.苏打B.氯化氢C.熟石灰D.烧碱12.可用于判断NaHCO3粉末中混有Na2CO3的实验方法是()A.加热时有无气体放出B.滴加盐酸时有无气泡放出C.溶于水后滴加氯化钡稀溶液,有白色沉淀生成D.溶于水后滴加澄清石灰水,有白色沉淀生成13.向200克4%的氢氧化钠溶液中,通入一定量的二氧化碳,反应后将所得溶液蒸干,得到固体13.7克,则通入的二氧化碳的体积为()A.1.12升B.2.24升C.3.36升D.4.48升【选做题】14.某同学用如下图所示装置制取纯净的氧气。试回答下列问题:(1)乙中Na2O2可能发生的反应有(写化学方程式)。(2)丙中NaOH溶液的作用是,丁中浓硫酸的作用是。(3)若把原装置连接顺序改为甲→丙→丁→乙→戊,则在装置戊中能否收集到氧气?(填“能”或“不能”),原因是。15.取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积的关系如图所示,试回答下列问题:(1)原NaOH溶液的物质的量浓度为mol·L-1。(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质为(写化学式);其物质的量之比为。(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为mL。课时6碳酸钠的性质与应用1.D解析:食品加工或餐饮业中使用量特别要注意严加控制的物质,说明该物质有毒性。A.食盐虽说不能吃太多,对心脏不好,但不需要严格控制;B.味精也不能过多食用,吃多了容易脱发,但也不需要严格控制;C.小苏打对人体危害较小(常用于面包的发酵),故不需要严格控制;D.亚硝酸盐有致癌的作用,故需要严格控制,故选择D。2.B解析:NaHCO3热稳定性差,加热可以分解产生CO2气体,...