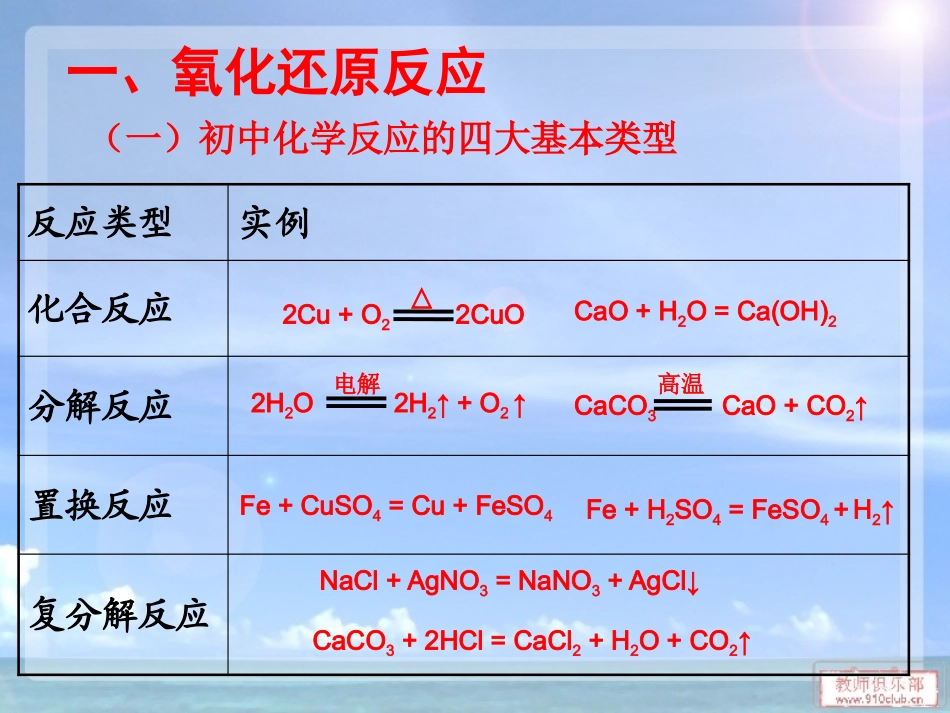
第一课时一、氧化还原反应(一)初中化学反应的四大基本类型反应类型实例化合反应分解反应置换反应复分解反应2Cu+O22CuO△CaO+H2O=Ca(OH)22H2O2H2↑+O2↑电解CaCO3CaO+CO2↑高温Fe+CuSO4=Cu+FeSO4Fe+H2SO4=FeSO4+H2↑NaCl+AgNO3=NaNO3+AgCl↓CaCO3+2HCl=CaCl2+H2O+CO2↑优点:例:Fe2O3+3CO2Fe+3CO2△根据反应物和生成物的类别和种类多少分类,直观、易懂、易判断。缺点:①不能反映化学反应的本质②不能包含所有化学反应。氧化还原反应1、从得失氧的角度进行分类氧化反应还原反应物质得到氧的反应物质失去氧的反应2CuO+C=2Cu+CO2↑△失氧,被还原(发生还原反应)得氧,被氧化(发生氧化反应)氧化反应——得氧;还原反应——失氧。开动脑筋:氧化反应和还原反应是分别独立进行的吗?从整体上看,氧化反应和还原反应同时发生,不能分开,有氧化必有还原。这样的反应称为氧化还原反应。氧化还原反应概念一种物质被氧化,另一种物质同时被还原的反应在Mg+O2=2MgO反应中,对于镁来说,Mg——MgO的反应是氧化反应,那么有还原反应存在吗?【思考】氧化反应和还原反应同时存在,同时发生,两者既对立,又统一,不能截然分开。因此2Mg+O2=2MgO是氧化反应的说法是片面的,应该是氧化还原反应。【小结】从得失氧的角度分析N2+3H2=2NH3、2Na+Cl2=2NaCl、H2+Cl2=2HCl三个反应是否属于氧化还原反应?上面的三个反应中虽无氧的得失,但属于氧化还原反应。因此,初中所学的概念有一定的局限性,有待于进一步的研究和学习。那么氧化还原反应的本质是什么呢?【思考】2CuO+C=2Cu+CO2↑△化合价降低,被还原化合价升高,被氧化+200+42、从元素化合价的角度分析下面反应【练习】Fe+2HCl=FeCl2+H2↑氧化还原反应的特征:反应前后元素化合价发生了变化【练习】下列反应是否属于氧化还原反应?有无共同特征?1、S+O2=SO23、Fe+CuSO4=FeSO4+Cu4、CaCl2+Na2CO3=CaCO3+2NaCl2、2HgO=2Hg+O20+40-20+2+20反应前后均有元素化合价变化,因此都属于氧化还原反应不属于氧化还原反应+200【小结】化合价升高---被氧化---发生氧化反应化合价降低---被还原---发生还原反应同时发生氧化还原反应的特征:反应中有元素化合价的改变从化合价的角度看,只要反应过程中物质的化合价有改变,就是氧化还原反应,与是否有氧的得失无关。这样就更全面、更科学的认识了氧化还原反应。↑[练习2]在CO2+C=2CO的反应中,C单质发生———反应;CO2中的C元素化合价——————,被——————,则CO2发生——————反应。从化合价升降的观点看,该反应属于————————反应。高温[练习1]下列反应属于氧化还原反应的是()A、CaCO3+2HCl=CaCl2+H2O+CO2↑B、CaCO3CaO+CO2↑C、Na2O+H2O=2NaOHD、Mg+2HCl=MgCl2+H2↑高温1、下列基本反应类型一定是氧化还原反应的是[]一定不是氧化还原反应的是[]A、化合反应B、分解反应C、置换反应D、复分解反应2、请分析四种基本反应类型的反应与氧化还原反应之间的关系,并试着画出它们之间的交叉分类示意图。氧化还原反应置换反应化合反应分解反应复分解反应化合反应分解反应氧化还原反应非氧化还原反应有单质参加无单质参加无单质生成有单质生成1、从得氧失氧的角度进行分析2、从元素化合价的角度进行分析化合价升高——被氧化——发生氧化反应化合价降低——被还原——发生还原反应得到氧——被氧化——发生氧化反应失去氧——被还原——发生还原反应得失氧的反应叫做氧化还原反应有化合价升降的反应叫做氧化还原反应第二课时氧化反应还原反应氧化还原反应从得失氧角度从元素化合价升降角度物质得氧的反应物质失氧的反应有得氧和失氧的反应物质所含元素化合价升高的反应物质所含元素化合价降低的反应元素化合价有升降的反应一、氧化还原反应在氧化还原反应中为什么会发生化合价的变化?以NaCl的形成为例(可以从Na、Cl的原子结构入手)NaCl的形成281+11287+17+NaClClNae-e-e-e-e-e-e-e-Na+e-e-e-e-e-e-e-e-NaClCl-失电子,得电子,2Na+Cl22NaCl点燃00+1-1化合价升高,被氧化化合价降低,被还原Na:失去电子,化合价升高,被氧化,发生氧化反应Cl:得到电子,化合价降低,被还原,发生还原反应从...