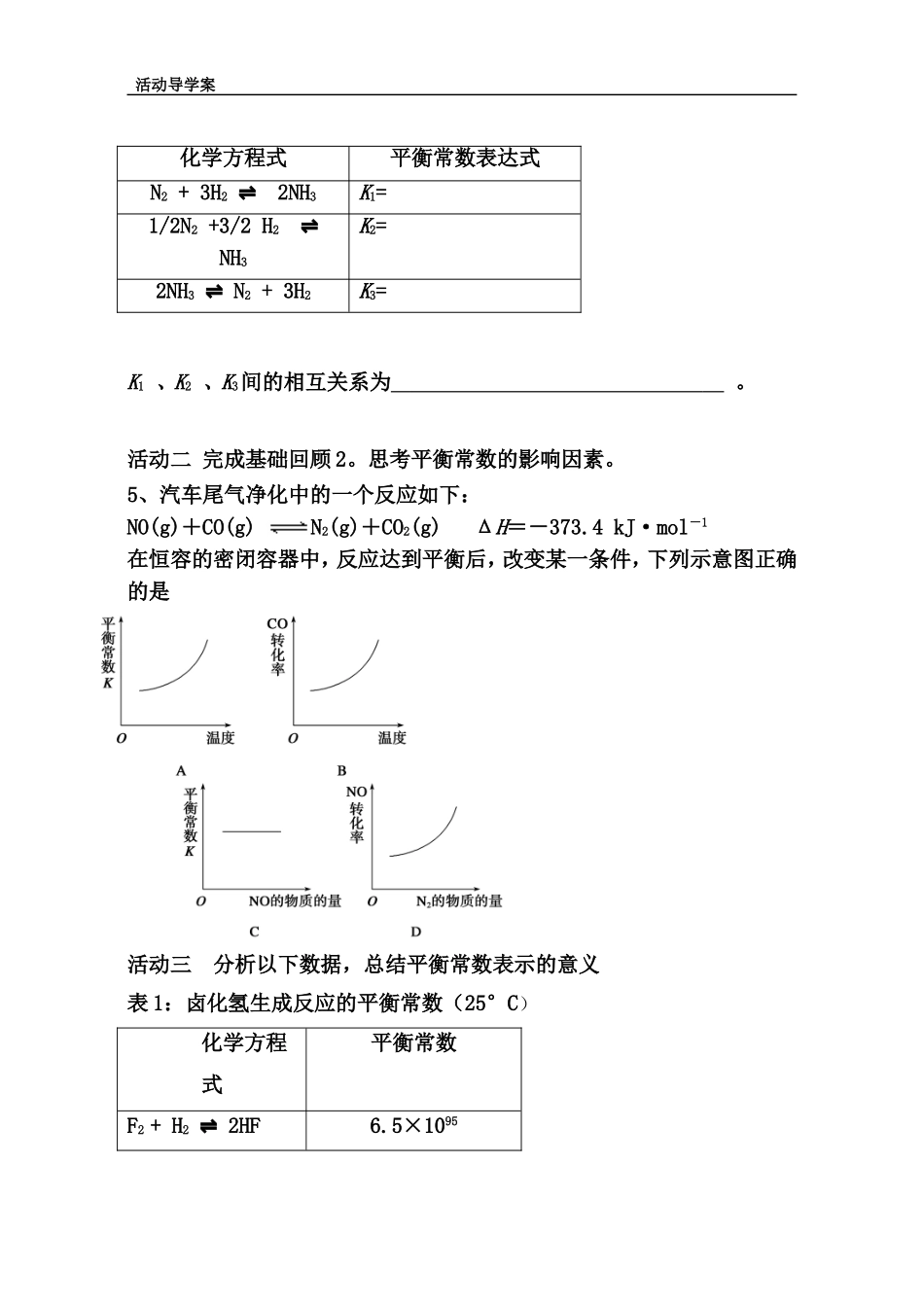
活动导学案选修四化学平衡常数【2013年考纲要求】1、理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。2、了解弱电解质在水溶液中的电离平衡。了解水的电离及离子积常数3、了解难溶电解质在水中存在沉淀溶解平衡。了解溶度积的含义。【学习目标】1、理解化学平衡常数K、电离平衡常数(Ka、Kb、Kw)、溶度积常数Ksp的含义,会书写相应的表达式。2、知道平衡常数的应用【活动方案】活动一完成基础回顾11、对于可逆反应:aA(g)+bB(g)⇌cC(g)+dD(g),其中a、b、c、d分别表示化学方程式中各反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数表达式为:。2、如CH3COOHCH⇌3COO-+H+,电离平衡常数。3、Kw的数学表达式是Kw=。4、Fe(OH)3(s)Fe⇌3+(aq)+3OH-(aq),溶度积常数思考:在相同温度下,对于同一个可逆反应,若书写方式不一样,平衡常数表达式是否一样?以合成氨反应为例进行说明。活动导学案K1、K2、K3间的相互关系为。活动二完成基础回顾2。思考平衡常数的影响因素。5、汽车尾气净化中的一个反应如下:NO(g)+CO(g)N2(g)+CO2(g)ΔH=-373.4kJ·mol-1在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是活动三分析以下数据,总结平衡常数表示的意义表1:卤化氢生成反应的平衡常数(25°C)化学方程式平衡常数F2+H22HF⇌6.5×1095化学方程式平衡常数表达式N2+3H22NH⇌3K1=1/2N2+3/2H2⇌NH3K2=2NH3N⇌2+3H2K3=活动导学案Cl2+H22HCl⇌2.57×1033Br2+H22HBr⇌1.91×1019I2+H22HI⇌8.67×102表2:常见难溶电解质的溶度积常数和溶解度(25°C)难溶物Ksp溶解度/g难溶物Ksp溶解度/gAgCl1.8×10-101.5×10-4CaCO35.0×10-97.1×10-4AgBr5.4×10-138.4×10-6Ag2CO38.1×10-123.2×10-3AgI8.5×10-172.1×10-7Fe(OH)32.6×10-393.0×10-9表3:几种弱酸的电离常数(25°C)多元弱酸电离方程式KaCH3COOHCH3COOHCH⇌3COO-+H+Ka=1.76×10-5H2CO3H2CO3⇌HCO3-+H+HCO3-⇌CO32-+H+Ka1=4.3×10-7Ka2=5.6×10-11H3PO4H3PO4⇌H2PO4-+H+H2PO4-⇌HPO42-+H+HPO42-⇌PO43-+H+Ka1=7.5×10-3Ka2=6.2×10-8Ka3=2.2×10-13活动四完成以下各题,总结平衡常数的应用。1、已知:25℃时H2CO3⇌HCO3-+H+Ka1=4.3×10-7HCO3-⇌CO32-+H+Ka2=5.6×10-11HClO⇌ClO-+H+Ka=2.95×10-8(1)若把H2CO3、HCO3-、HClO都看作是酸,其中酸性最强的是____,最弱的是___。(2)请根据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:活动导学案①将少量的氯气通到过量的碳酸钠溶液中。②在过量的氯水中滴入少量的碳酸钠溶液。2、在一定温度下,反应1/2H2(g)+1/2X2(g)⇌HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于A.5%B.17%C.25%D.33%3、水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。某温度下,四个容器中均进行着上述反应,各容器中炭足量,其他物质的物质的量浓度(单位:mol/L)及正逆反应速率关系如下表所示。容器编号c(H2O)c(CO)c(H2)v正与v逆关系Ⅰ0.060.600.10v正=v逆Ⅱ0.060.500.40②?Ⅲ0.120.400.10③?Ⅳ0.120.30①?v正=v逆1)请根据上表数据计算出该温度下该反应的平衡常数的数值。2)填写表中相应的空格4、判断反应放热或吸热[△H<(或>)0]总结:化学平衡常数是联系同一个反应在不同条件下达到平衡状态的桥梁,是定量分析某个可逆反应的核心和纽带,是定性问题不能定性分析时的抓手。