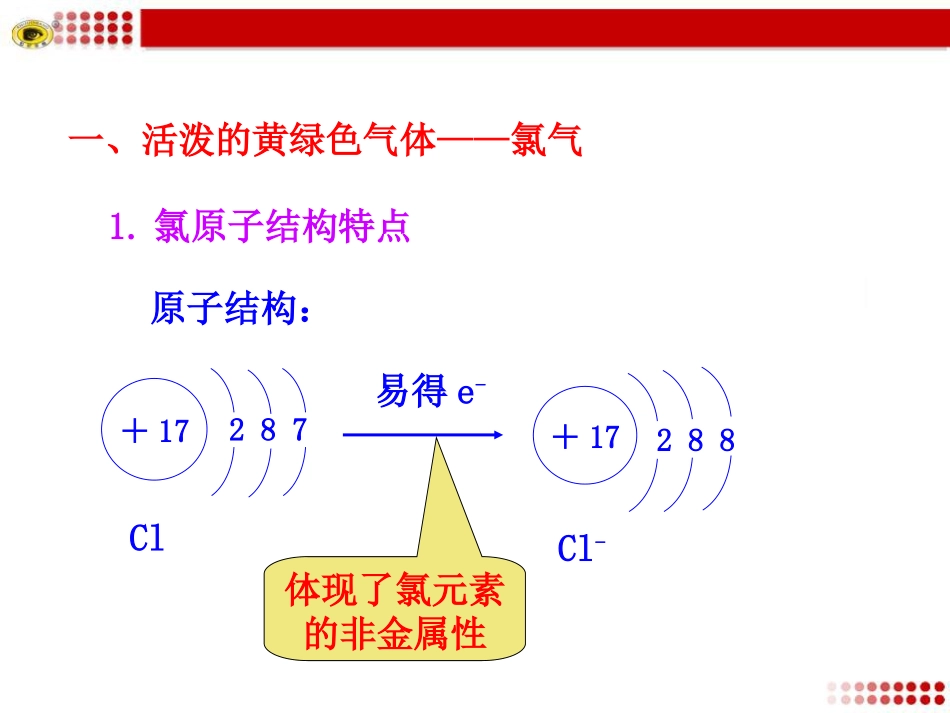
第二节富集在海水中的元素——氯1.氯原子结构特点原子结构:一、活泼的黄绿色气体——氯气易得e-+17287Cl+17288Cl-体现了氯元素的非金属性MnO2+4HCl(浓)====MnCl2+2H2O+Cl2↑2.氯气的实验室制法(1)实验原理△(1)生成1mol氯气,转移电子的物质的量是多少?(2)浓盐酸的作用是什么?【提示】(1)2mol(2)起还原性、酸性作用【想一想】3.氯气的物理性质颜色:状态:气味:密度:毒性:水溶性:黄绿色气体,易液化刺激性气味比空气大有毒能溶于水(1体积水可溶解2体积氯气)【提示】不能用排水法收集,可用排饱和食盐水法收集。闻气体气味的方法【想一想】(1)如何闻氯气的气味?【提示】用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。(2)能否用排水法收集氯气?②氯气与铜反应①氯气与铁反应⑴氯气与金属反应4.氯气的化学性质小结:氯气与变价金属反应,生成其高价氯化物。2Fe+3Cl2====2FeCl3点燃Cu+Cl2====CuCl2点燃氯气与氢气反应⑵氯气与非金属反应实验现象:纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。点燃H2+Cl2====2HCl【提示】燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。任何发光发热的剧烈的化学反应都叫做燃烧。通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?【思考与交流】(3)氯气与水反应Cl2+H2O====HCl+HClO强氧化性漂白作用弱酸性不稳定性用于自来水的杀菌、消毒用作漂白剂酸性:H2CO3>HClO次氯酸的性质2HClO====2HCl+O2↑光照请你设计一个实验验证具有漂白性的是次氯酸而不是氯气。【实验探究】结论:1.干燥的氯气没有漂白性。2.湿润的氯气有漂白性,因为氯气溶于水生成次氯酸。3.尾气用NaOH溶液吸收。(4)氯气与碱反应Cl2+2NaOH====NaClO+NaCl+H2O有效成分:NaClO2Cl2+2Ca(OH)2====Ca(ClO)2+CaCl2+2H2O漂白粉、漂粉精漂白液有效成分:Ca(ClO)2Ca(ClO)2+CO2+H2O====CaCO3↓+2HClOCa(ClO)2+2HCl====CaCl2+2HClO漂白原理:氯水、漂白液、漂白粉、漂粉精的漂白作用都是由反应生成的HClO引起的。二、氯离子(Cl-)的检验1.试剂:AgNO3溶液稀HNO32.原理:Ag++Cl–====AgCl2Ag++CO32-====Ag2CO3Ag2CO3+2H+====2Ag++CO2+H2O3.氯离子检验的一般步骤:②待测液加稀硝酸加硝酸银溶液白色沉淀①待测液加稀硝酸加硝酸银溶液白色沉淀一、氯气(Cl2)1.物理性质2.化学性质(强氧化性)3.制备(原理——装置——除杂——收集)二、Cl-检验1.试剂——AgNO3溶液和HNO3溶液2.操作方法三、卤族元素FClBrI1.结构2.性质1.下列化合物中,不能由氯气和相应的金属直接反应来制取的是()A.FeCl3B.CaCl2C.FeCl2D.KClC2.不能用于检验新制氯水和长期放置的氯水的试剂是()A.紫色石蕊试液B.品红溶液C.FeCl2溶液D.AgNO3溶液D3.将Cl2通入自来水中杀菌消毒,主要是利用了Cl2与H2O生成的HClO的()A.氧化性B.酸性C.还原性D.稳定性A4.(双选)下列关于氯水的叙述中正确的是()A.新制氯水中只含有Cl2和H2O分子B.新制的氯水可使蓝色石蕊试纸先变红后褪色C.光照氯水有气泡逸出,该气体是Cl2D.氯水放置数天后,酸性增强BD5.当周围有大量Cl2逸出时,可用含有某种物质的水溶液的毛巾捂住鼻子,该物质最好是()A.NaOHB.NaClC.Ca(OH)2D.Na2CO3D当你明白了“成功不会造就你,失败不会击垮你”时,你就站在了最高处。如果你能像看别人的缺点一样,如此准确地发现自己的缺点,那么你的生命将会不平凡。液氯、新制氯水、久置氯水的比较液氯分类成分性质纯净物混合物分子:离子:Cl2,HClO,H2OH+,Cl-,ClO-分子:H2O离子:H+,Cl-新制氯水有氧化性,无酸性和漂白性有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置氯水只有Cl2只有酸性混合物【思考与交流】(2)实验装置浓盐酸MnO2饱和食盐水除HCl浓硫酸除H2O收集Cl2NaOH溶液吸收尾气