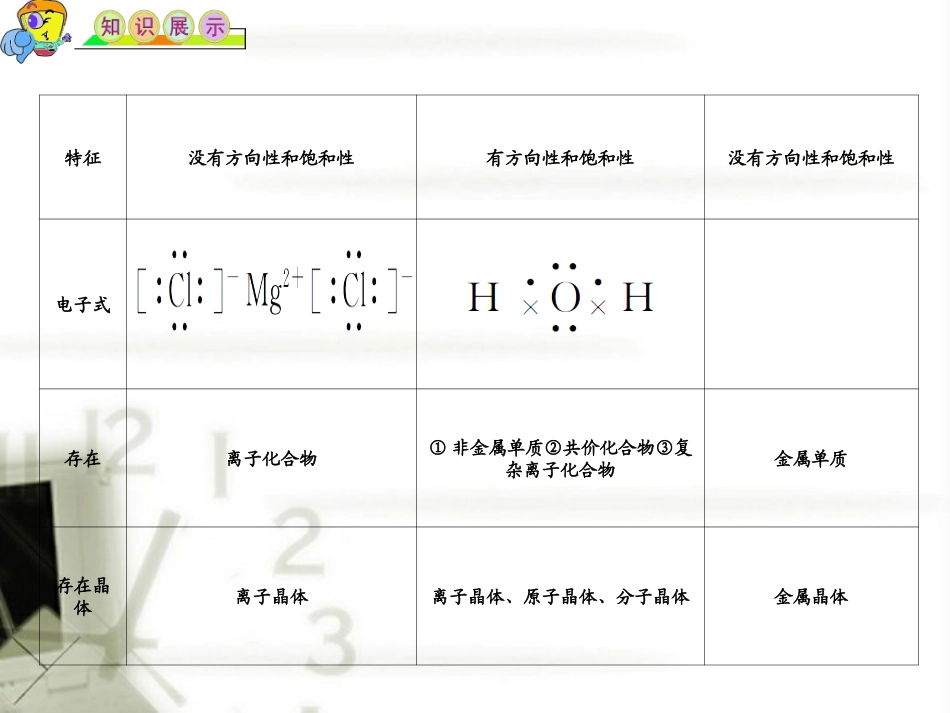
(1)一、离子键、共价键、金属键1.比较比较离子键共价键金属键定义阴阳离子之间的相互作用原子间通过共用电子对所形成的化学键金属原子与自由电子间的相互作用成键本质阴阳离子的电性作用共用电子对对两原子核的电性作用金属阳离子与自由电子间的电性作用成键粒子阴阳离子原子金属原子与自由电子成键元素一般是活泼金属与活泼非金属(或原子团)一般是非金属与非金属或较不活泼的金属金属元素特征没有方向性和饱和性有方向性和饱和性没有方向性和饱和性电子式存在离子化合物①非金属单质②共价化合物③复杂离子化合物金属单质存在晶体离子晶体离子晶体、原子晶体、分子晶体金属晶体2.共价键类型σ键π键成键方向沿键轴方向“头碰头”平行或“肩并肩”电子云形状轴对称镜像对称牢固程度一般强度大,不易断裂一般强度小,易断裂成键判断规律单键是σ键;双键有一个是σ键,另一个是π键;叁键中一个是σ键,另两个为π键(1)σ键和π键(2)极性键和非极性键非极性键极性键定义由同种元素的原子形成的共价键,共用电子对不发生偏移由不同种元素的原子形成的共价键,共用电子对发生偏移原子吸引电子能力相同不同共用电子对位置不偏向任何一方偏向吸引电子能力强的原子一方成键原子的电性判断依据不显电性显电性举例单质分子(如H2、Cl2)和某些化合物(如Na2O2、H2O2)中含有非极性键气态氢化物,非金属氧化物、酸根和氢氧根中都含有极性键1.由非极性键形成的双原子、多原子分子,其正电中心和负电中心重合,所以都是非极性分子。2.含极性键的分子有没有极性,必须依据分子中极性键的极性向量和是否等于零而定。当分子中各个键的极性的向量和等于零时,是非极性分子。当分子中各个键的极性向量和不等于零时是极性分子。二、分子的极性(3)配位键:一类特殊的共价键,一个原子提供空轨道,另一个原子提供一对电子所形成的共价键。a.以极性键结合成的双原子分子是极性分子。如:HCl、HF、HBr。b.以非极性键结合成的双原子分子或多原子分子大多是非极性分子。如:O2、H2、P4、C60。c.以极性键结合的多原子分子,可能是极性分子也可能是非极性分子。d.在多原子分子中,中心原子上价电子都用于形成共价键,而周围的原子是相同的原子,一般是非极性一般规律:相似相溶规律:极性溶质一般能溶于极性溶剂;非极性溶质一般能溶于非极性溶剂。如Br2、I2易溶于苯或四氯化碳中,而在水中溶解度较小。如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越大。相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较小。1.杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。杂化轨道数=中心原子价电子对数三、杂化轨道理论2.对于ABn型分子,中心原子价电子对数可通过下式确定:中心原子价电子对数=(O原子与S原子按不提供价电子计算)中心原子(A)形成的价电子数+配位原子(B)提供的总价电子数23.杂化轨道的形状:2个sp杂化轨道呈直线形,3个sp2杂化轨道呈平面三角形,4个sp3杂化轨道呈四面体形。化学式中心原子价电子对数中心原子杂化轨道数中心原子孤对电子对数中心原子杂化轨道类型空间构型CH4440sp3正四面体BF3330sp2平面三角形CO2220sp直线形NH3441sp3三角锥形H2O442sp3V形SO2331sp2V形NH440sp3正四面体1.杂化轨道数=孤对电子对数+成键电子对数2.价层电子互斥理论:未成键的孤对电子对已成键的共用电子对有一定的排斥作用。中心原子的价电子对(包括孤对电子和成键电子对)之间存在相互排斥作用,分子的几何构型总是采取彼此间排斥力最小的结构,因为这样能量最低。在分子中,孤对电子和成键电子对之间静电排斥作用大小的顺序如下:孤对-孤对>孤对-成键对>成键对-成键对。3.价层电子对互斥模型(VSEPRmodels):标注键合原子、孤对电子,并用球棍分别表示中心原子、键合原子、孤对电子成键情况的模型叫VSEPR模型。4.路易斯结构式:标注孤对电子的结构式。具有相同电子数(指分子或离子中全部电子总数)和相同原子数的分子或离子,它们往往具有相同的分子结构(几何构型)及相似的...